Из чего получают антитела для прививок
Производство вакцин – многоступенчатый, длительный процесс, который требует участия тысяч человек и серьезных материальных вложений. Его стандарт был разработан в середине XX века. На сегодняшний день в мире зарегистрировано около 100 вакцин, и ученые накопили достаточно опыта, чтобы быстро отреагировать и разработать новый препарат в случае критической ситуации.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
В разработке принимают участие ученые разных направлений – вирусологи, биологи, иммунологи, бактериологи и другие. И на первом этапе им необходимо не только выявить возбудителя и «опознать» его, но и тщательно изучить особенности жизнедеятельности, генетического материала, антигенов. Более того, перед исследователями стоит задача понять, как организм отвечает на проникновение микроба, какие иммунные механизмы задействованы.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
in vitro – это технология выполнения опытов «в пробирке», т.е. вне живого организма.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
НА ЗАМЕТКУ! Возникает вопрос: почему бы тогда не создать одну вакцину, например, от гриппа, и делать прививку каждый год, не вспоминая об этом заболевании? Дело в том, что вирус гриппа постоянно мутирует, свойства антигенов изменяются, и ученым приходится ежегодно создавать новые препараты. Но это не значит, что новую вакцину делают «наугад». ВОЗ располагает сетью специализированных центров, в которых происходит сбор данных о вспышках гриппа по всему миру. Ученые непрерывно анализируют штаммы, выявляют новые разновидности, проводят антигенные исследования. То есть, состав будущего препарата обоснован конкретными фактами. Более подробно о вакцине от гриппа можно почитать в нашей статье: «Вековая война с гриппом: про вакцины от начала до наших дней». К слову, другая ситуация с ВИЧ. Мутации этого вируса происходят в несколько раз чаще, чем гриппа. «Уловить» изменения на данный момент исследователи не могут, поэтому вакцины от него нет.
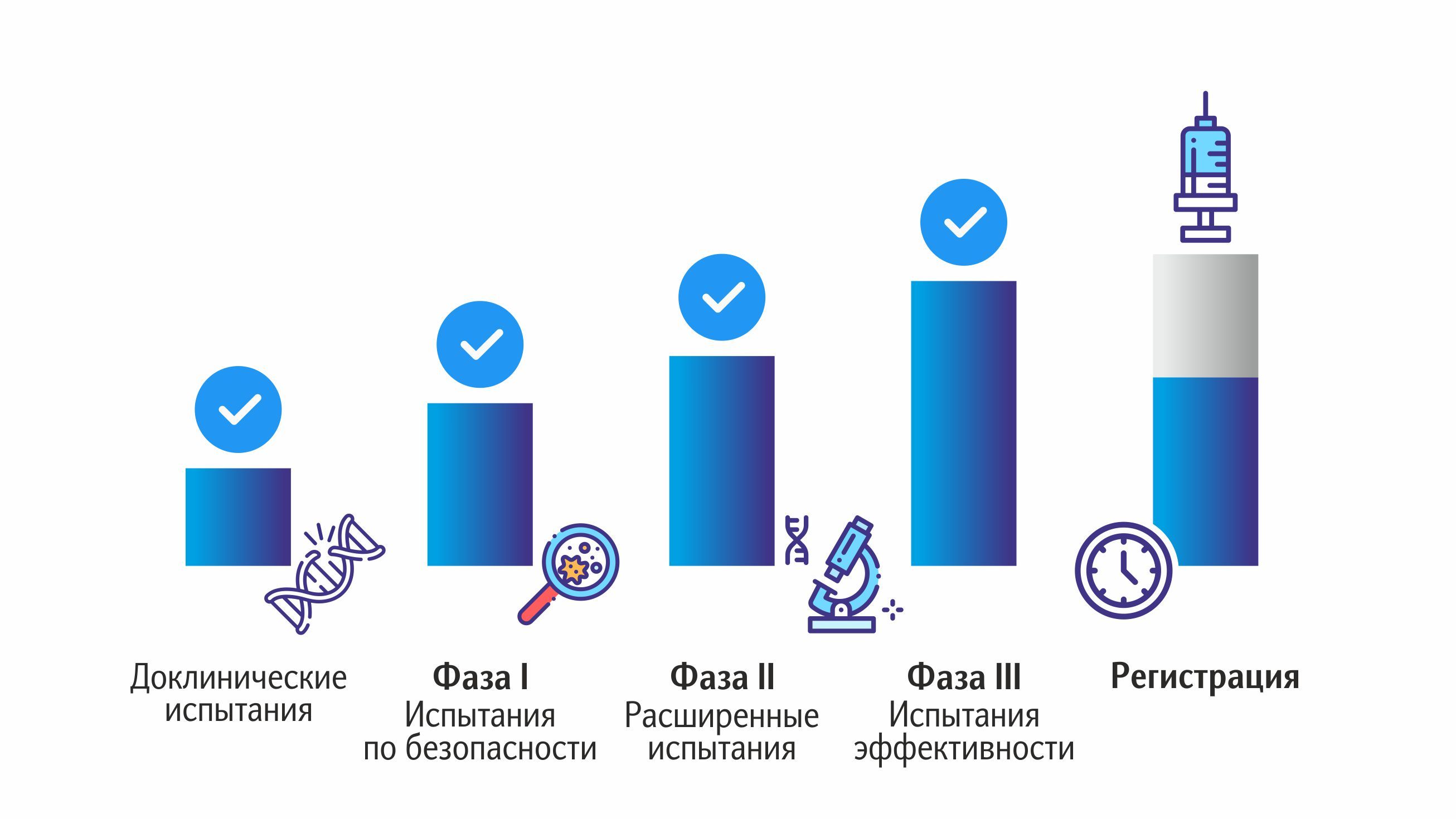
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
- происходит оценка возможности вакцины формировать иммунитет;
- выявляется токсичность препарата для живого организма;
- определяется минимальная, оптимальная и максимально допустимая дозировка;
- исследуется воздействие на плод (вероятность развития аномалий и прочее);
- оценивается способность препарата влиять на образование и/или рост опухолей;
- оцениваются аллергизирующие свойства и так далее.
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
ЭТО ИНТЕРЕСНО! Своеобразные «прививки» от оспы делали в Китае в 15 веке. У больного человека брали струпья, растирали в порошок и давали вдыхать здоровому. Среди других вариантов «вакцинации» – надетое на здорового человека белье инфицированного или вкладывание в ноздри ватного тампона, пропитанного гнойным содержимым язв. Какими бы варварскими не казались нам эти методы сейчас, в то время они реально помогали!
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
- переносимость и побочные явления;
- особенность иммунного ответа (скорость, выраженность и другие);
- взаимодействие с другими препаратами;
- безопасность диапазона доз.
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Дальнейшая «жизнь» вакцины
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
НА ЗАМЕТКУ! Стоит коснуться и такого вопроса, как материальные затраты. Разработка вакцины требует огромных вложений. Это и заработная плата сотрудникам, и содержание лабораторий и центров, содержание животных, реагенты и многое-многое другое. Кроме того, значительная доля от продаж уже зарегистрированного препарата уходит на постклинический мониторинг – сбор, фиксацию и анализ данных.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
- Выбирают штамм возбудителя.
- Ослабляют микроорганизм.
- Размножают (культивируют) в питательной среде.
- Очищают от примесей.
- Стандартизируют (приводят к нужной концентрации, фасуют).
2. Инактивированная вакцина (убитые возбудители).
- Выбирают штамм.
- Культивируют.
- Инактивируют (убивают).
- Очищают.
- Стандартизируют.
3. Рекомбинантная вакцина. Используются методы генной инженерии.
- У патогенного возбудителя берут часть генетического материала.
- Встраивают его в геном клеток, которые будут его производить (чаще всего, это – дрожжи).
- Культивируют клетки в питательной среде.
- Выделяют и очищают антиген.
- Готовят вакцину.
Кроме этого, существуют и другие способы производства вакцин, инновационные и дорогостоящие, например, полное воссоздание вируса искусственным путем. Иммунитет реагирует на него, как на «живого», но вероятность заражения нулевая, так как в такой частице отсутствует геном.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
- Базовые исследования – 2-4 года;
- Доклинические испытания – до 2-х лет;
- Первая фаза клинического этапа – 1-5 лет;
- Вторая фаза – 2-3 года;
- Третья – 5 и более лет.
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
В ряде ситуаций допускается экстренный выпуск препаратов. Однако это не означает, что они «не проверены». В любом случае вакцина проходит установленные протоколом этапы, но в очень сокращенном варианте. В качестве примера можно взять COVID-19 или вирус Эбола.
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.
Читайте также
Как люди смогли выжить без вакцин?
Безопасно ли делать прививки во время пандемии COVID-19?
Защищает ли вакцинация ВПЧ от рака шейки матки?
Источник
Разработчики «ЭпиВакКороны» опубликовали официальные результаты I-II фаз клинических исследований вакцины. «Множество странностей и отсутствие логики», – так прокомментировали статью «Доктору Питеру» эксперты.
Вместо зарубежного журнала – малоизвестный
О том, что результаты исследований вакцины «ЭпиВакКорона» планируется направить в международные журналы, было впервые заявлено в научном центре «Вектор» в ноябре прошлого года. В феврале уже 2021 года сообщалось, что «Вектор» направил результаты клинических исследований вакцины фазы I-II в зарубежные научные рецензируемые журналы. «Их публикация ожидается в ближайшее время, – заявили в Роспотребнадзоре. – Обнародование результатов в русскоязычных научных изданиях до выхода соответствующих международных публикаций не представляется целесообразным в силу их эксклюзивности и значимости для широкого круга потенциально заинтересованных лиц». Спустя месяц статья появилась в российском журнале «Инфекция и иммунитет», который издает НИИ им. Пастера Роспотребнадзора.
«Что является показателем крутости журнала? Так называемый импакт-фактор (ИФ), который говорит о том, насколько часто цитируются публикации этого журнала учеными, – говорит вирусолог Маргарита Романенко. – Почти все российские журналы имеют ИФ меньше единицы, то есть их статьи очень мало цитируются. А вот у журнала Lancet, где опубликованы уже две статьи по результатам испытания «Спутника» ИФ 60. А у журнала The New England Journal of Medicine, в который якобы метили векторовцы — 75. Журнал «Инфекция и иммунитет» имеет импакт-фактор – 0,638. Почти в 100 раз меньше, чем у Lancet».
Магическая природа вакцины
«Первое, что бросается в глаза — это аналогия со «Спутником» по результатам сравнения концентрации вирус-специфических антител у привитых и переболевших, – рассказал «Доктору Питеру» врач-биофизик Кирилл Скрипкин. – У «Спутника» концентрация антител у привитых была в среднем в 8 раз выше, чем у переболевших, по данным из статьи в «Ланцете». У «ЭпиВакКороны» концентрация антител у привитых в 11 раз меньше, чем у переболевших. Напомню, что это количество просто связывающих антител, не нейтрализующих. Количество нейтрализующих вирус антител разработчики «Вектора» почему-то решили с количеством этих антител у переболевших не сравнивать, в отличие от разработчиков центра Гамалеи. Но, по крайней мере, по результатам этой статьи, нейтрализующие антитела после «ЭпиВакКороны» есть. В итоге моя картина мира не поменялась, «ЭпиВакКорона» имеет право на существование в качестве бустера для ревакцинации, что также должно быть сначала доказано в клинических исследованиях».
Читайте также: Привитые «ЭпиВакКороной» снова пишут в Минздрав: «в крови нет антител к коронавирусу после вакцинации»
«Самое большое возмущение вызывает тот факт, что в статье по-прежнему не раскрыты конкретные пептиды, на которых построена вакцина, – говорит профессор Сколтеха Дмитрий Кулиш. – То есть «Вектор» продолжает играть в столь любимую постсоветскими учёными игру в «мага-волшебника», у которого в пробирке булькает секретное зелье, лечащее все болезни, и маг отгружает это зелье по сходной цене, но никогда никому не расскажет о том, как он это зелье варит. Именно поэтому «Вектор» никому не даёт свой вакцин-специфический ИФА, именно поэтому даже в статье не говорится, какие же пептиды вставлены в вакцину».
Но на главный вопрос, почему при заявленной 100-процентной эффективности «ЭпиВакКороны» тесты вакцинированных показывают только 75%, публикация разработчиков «ЭпиВакКороны» все же дала ответ.
«Оказывается, у «Вектора» есть два разных теста ИФА, видящих вакцинные антигены, – один на цельный вирион, а другой – на вакцин-специфические пептиды, – говорит Дмитрий Кулиш. – Второй (главный и самый чувствительный) они никому не дают, а первый – раздали и объявили вакцин-специфическим. При этом, разумеется, никому ничего не объяснили. Но оттого мы так и любим публикации, с нетерпением ждём – именно в них тайное становится явным. Приходится констатировать, что у «Вектора», действительно, есть ИФА, по которому, действительно, происходит 100-процентная сероконверсия после укола «Эпиваком». Этот тест заботливо скрыли от пациентской группы, что является поведением антиобщественным, но уголовно ненаказуемым».
Сейчас, по словам профессора Кулиша, авторы статьи, не раскрыв ключевой метод – секретный пептид-специфичный ИФА, обязаны либо исправить эту «детскую ошибку», либо отзывать статью и официально признавать магическую природу «ЭпиВакКороны».
Читайте также: «ЭпиВакКорона» – живая или мертвая вода? Почему ученые называют ее особо секретной вакциной
Загадочные плацебники
Еще одно «магическое», ничем не объяснимое в публикации «Вектора», свойство «ЭпиВакКороны» – вызывать антитела даже у плацебников, поставило экспертов «Доктора Питера» в тупик. Если верить статье, специальный «засекреченный» тест на антитела к вакцинным антигенам «ЭпиВакКороны» показал отличные результаты у плацебо-группы, вакцинированной физраствором, – максимальный титр у плацебников достиг 1:800, а средний геометрический титр в плацебо-группе к 21-му дню вплотную подобрался к 1:200 – такой же минимальный титр специальных антител указан для группы вакцины на 42-й день.
«Наличие антител у плацебо-группы, конечно, очень смущает, – говорит вирусолог Маргарита Романенко. – При этом антитела то появляются, то исчезают. Но это никак не обсуждается, так же как и нет ответа на вопрос, откуда антитела вообще появились у плацебников. Мы можем только предполагать, почему это случилось — либо что-то не так с тест-системой, которая детектирует у людей то, что у них быть не может, либо эти люди подвергались коронавирусной инфекции, но в таком случае, куда потом делись эти антитела, если они и в самом деле у них были».
Читайте также: Инфекционист Боткинской больницы объяснил, почему кому-то не нужна прививка от коронавируса, а нужен тест на антитела
«Отмалчиваться аморально»
Участники клинических исследований, объединившись в группу в Телеграме, сегодня готовят уже третье открытое письмо – на это раз не в Минздрав (напомним, в первом открытом письме в Минздрав они просили «расслепить» исследование, чтобы понять, кто получил вакцину, а кто плацебо, а во втором — провести независимую проверку «ЭпиВакКороны»), а научному и медицинскому сообществу: «Отмалчиваться в данной ситуации аморально», – говорят добровольцы. Сейчас, по словам администратора группы Андрея Криницкого, они копят данные о людях, которые заразились ковидом, в том числе тяжело, уже после вакцинации. Примечательно, что в статье «Вектора» описан один случай заражения коронавирусом 18-летним пациентом из группы вакцинированных. На малой выборке (в данном исследовании приняло участие всего сто человек. Другое, более масштабное, с участием трех тысяч добровольцев пока продолжается – Прим. ред.) — случай показательный.
«На 43-й день после вакцинации у пациента развился тяжёлый кашель, появилась высокая температура, тест ПЦР на коронавирус дал положительный результат. То есть это довольно существенная вирусная нагрузка. Это все как интерпретировать? В обсуждении про это ни слова», – задается вопросом молекулярный биолог Ольга Матвеева.
Роспотребнадзор в ответ на всю критику заявил, что «ЭпиВакКорона» создает три линии иммунной защиты (две линии— нейтрализующие антитела, третья линия — Т-клеточный ответ), сегодня опубликована схема эффективной работы вакцины. При этом, в самой научной публикации почему-то нет никаких данных о Т-клеточном ответе.
Ирина Фигурина
© Доктор Питер
Источник
