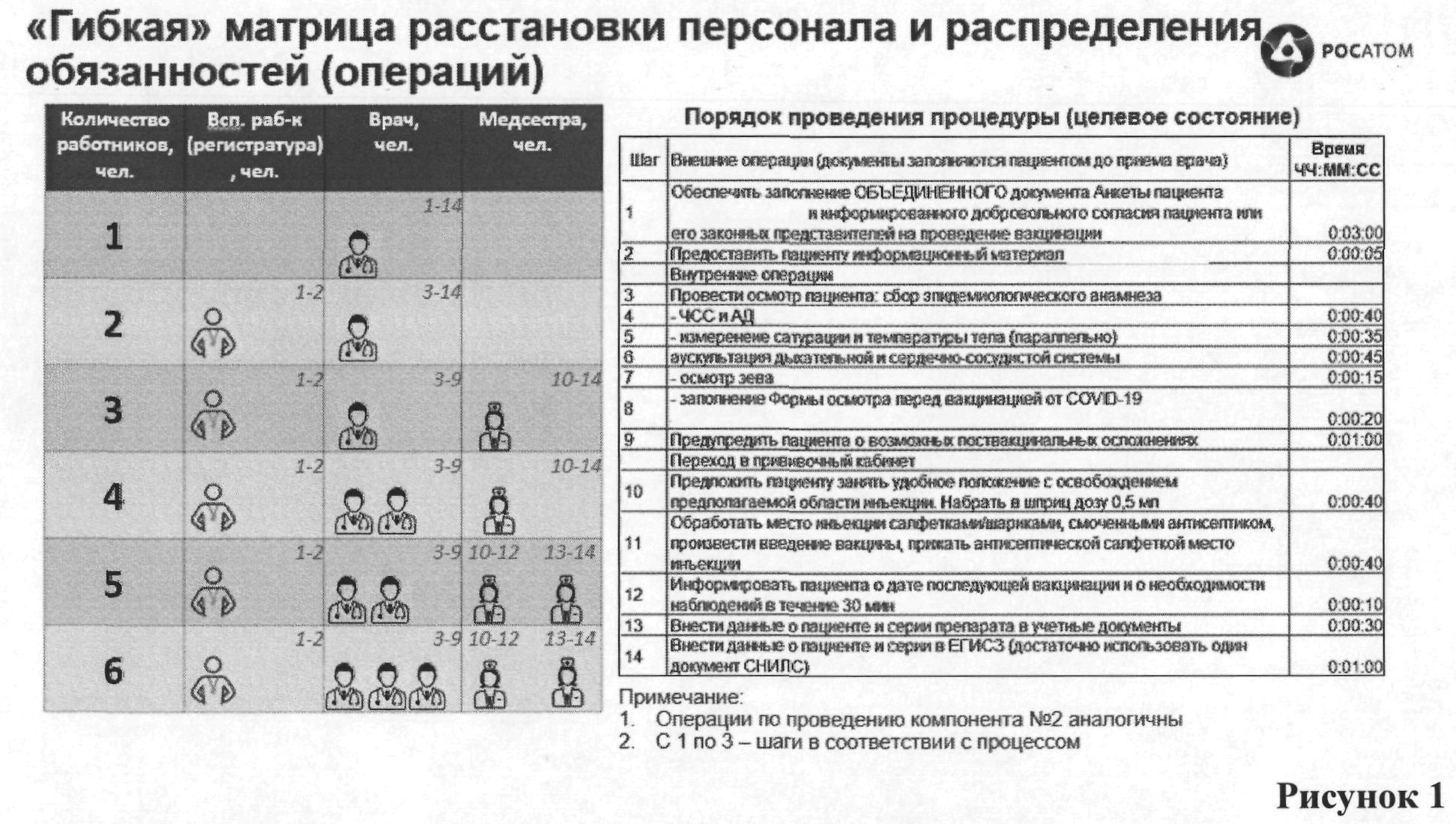
Методические рекомендации по проведению прививок

–
21 2021. N1//1-333 ” — COVID-19 ”
21 2021. N1//1-333 ” — COVID-19 “
” — COVID-19 “, COVID-19 ( ” ” ) “”.
: 33 . 1 .
” — COVID-19 “
COVID-19 ( ” ” ) , “”.
1.
1.1. COVID-19 .
1.2. , , COVID-19 , COVID-19 .
1.3. , – , ” ( )” .
2. COVID-19
2.1. COVID-19 – , , , , () ” ( )”.
2.2. COVID-19 , , .
2.3. COVID-19 . , – , . , () ” ( )”.
2.4. COVID-19 . COVID-19 , , , , , ” “.
2.5. .
2.6. , , , ( ), , ” ” , .
2.7. COVID-19 “–” ( – ), , , , .
2.8. .
2.9. : (COVID-19) 18 .
2.10. :
– – , ;
– ;
– , – 2-4 . , ;
– ;
– 18 ( ).
2.11. II:
( , , , 40 ..) I .
2.12. : , ( ), , , , , , .
2.13. :
– ( , , );
– .
2.14. : , , . , , , , 1 – .
2.15. .
3.
3.1. , .
4.
4.1. – .
4.2. :
– (, );
– (, , );
– ;
– COVID-19.
5. COVID-19
5.1. COVID-19 , , , . .
5.2. COVID-19 , , , , , ( N1), ( N4), 20 21.11.2011 N323- ” “.
5.3. (, -) , , ( ), , , , – , COVID-19 ( N3). ( N2).
5.4. , (, -) .
5.5. COVID-19 , , .
5.6. ( 18) , , , , .
5.7. I II . 3,0 . 0,5 . : , !
5.8. . .
5.9. ( ), – ). .
5.10. ().
5.11. “–” , . I II COVID-19 .
6. COVID-19
6.1. , , , , , COVID-19 *.
6.2. COVID-19 ( ):
7. COVID-19
7.1. , , , , , COVID-19 .
7.2. COVID-19 ( ):
7.3. , , .
7.4. , .
7.5. , , , .
7.6. COVID-19 (-, , -).
7.7. :
– COVID-19 ;
– , ;
– , ;
– , , , ( ) ;
– ;
– , , ;
– , – ;
– .
8.
8.1. – (0,5 / ) (3,0 ). , 3,0 , , 5 0,5 . 3,0 2 . 0,5 . 0,5 .
8.2. I II . : , , !
8.3. , . . , . . 2,0 , 0,5 , . ( ) .
8.4. . . ( ). – .
8.5. : I 0,5 , 21 II 0,5 .
9.
9.1. 15.02.2017 N1071 ” ” .
9.2. ” , ” ( 12.04.2019).
9.3. () (, -) : (. 025-87), (. 156/-93), (. 064).
9.4. , , (. 060), – (.110/) (. 003-1/).
9.5. (), , , () :
– , , ;
– () (), , .
9.6. () (), , , , , :
– 2 ( , , , , ), , – ; () ;
– ;
– 12 – ( ) (), , :
– () , – ( 04.02.2016 N11 ” – “;
– “” ( ).
9.7. , , , .
9.8. , , , , :
– ,
– /
– /
– , , , , .
– ()
– –
– /
– , , , , , ,
– , ,
9.9. () ( ), , (, , , , .), , , () ().
9.10. ( – ), ().
9.11. ( 1 ” , “, 12.04.2019)), ( 6 ).
9.12. – (, , -, ) .
9.13. () , , ( ) # ( ” 2.0″ ), .
9.14. , 12.04.2010 N61- ” “.
10. , “–”
10.1. “–” , , .
10.2. , , .
10.3. , , .
10.4. , “–“, .
10.5. “–” – , . .
10.6. , “–” .
10.7. .
10.8. “–” , . .
10.9. :
– ( );
– ( );
– -, ( ).
10.10. , “–” .
10.11. , “–” , , , , , – , 4.
10.12. .
10.13. – , , .
10.14. , (, ), , .
10.15. “–” , , .
10.16. ” ” “–” .
10.17. “–” , , , . , () “–“, ( 18 ) .
10.18. “–” , ” ” , , ” ” . 3.3.2.3332-16.
10.19. ( ).
11. /
11.1. – , .
11.2. / , ().
11.3. / , , .
11.4. / , , .
11.5. . . . , , , , .
11.6. . .
11.7. :
– , ;
– ;
– ;
– ;
– / ;
– ;
– .
11.8. / () .
11.9. , /, .
11.10. / : ( ), , /. , . , , .
11.11. . / , . , , .
12.
– 17.07.1998 N157- ” “;
– 21.11.2011 N323- ” “;
– 12.04.2010 N61- ” “;
– 16.04.2012 N291 ” ( , , , “”)”;
– 15.05.2012 N543 ” – “;
– 31 2020. N373 ” (COVID-19)”;
– 03.03.2008 N15 ” – 3.3.2342-08″ ( ” 3.3.2342-08. . – “);
– 04.06.2008 N34 ” – 3.3.2367-08″ ( ” 3.3.2367-08. . – “);
– 3 2020. N41 ” – 3.1.3671-20 ” (COVID-19) –“;
– 03.04.2020 N440 ” 2020 “;
– 16.04.2012 N291 ” ( , , , “”)”;#
– / ;
– ” , “, 12.04.2019;
– 15.02.2017 N1071 ” “.
13. , ,
______________________________
* ( 1) COVID-19 ( 2):
– 1 , 1 – 60 ;
– 2 , 1 – 120 ;
– 3 , 1 – 180 . ( : 10 ./ – , 30 ./ – , ()).

N1
N2
“–” – , SARS-CoV-2
:
I (, , ) ________________________________
II (, , ) ________________________________
:
– ( , , , , , , , ) ( , , ) . , , , – . .
3- , , , , . , , . – .
3 . – .
N3
COVID-19
:
COVID-19 ()
____________________________ ___________________________
N4
COVID-19 “–“
!
– ! , , ( ) , :
1. , COVID-19 G SARS-CoV-2 .
2. :
– – , ;
– ;
– ;
– ( 2-4 );
– ;
– 18 .
3. , , , – .
.
4. : I 0,5 . . 21 II 0,5 . .
5. 30 .
6. ( I II ) – ( , , , , , , , ) ( , , ) .
, , , – . .
3- , , , , .
, , . – .
COVID-19 , .
COVID-19 –. . , . .
Источник
О методических рекомендациях по проведению вакцинопрофилактики, с целью практического использования для решения вопроса возможности проведения профилактических прививок при подозрении риска развития поствакцинального осложнения
Министерство здравоохранения Российской Федерации направляет, подготовленные специалистами ФГАУ “Национальный научно-практический центр здоровья детей” Минздрава России, методические рекомендации, предназначенные для главных врачей поликлиник, врачей-педиатров, терапевтов, врачей общей практики, а также специалистов, участвующих в проведении вакцинопрофилактики, с целью практического использования для решения вопроса возможности проведения профилактических прививок при подозрении риска развития поствакцинального осложнения.
С.А.Краевой
Противопоказания к вакцинации. Методические рекомендации предназначены для главных врачей поликлиник, врачей-педиатров, терапевтов, врачей общей практики, а также специалистов, участвующих в проведении вакцинопрофилактики, с целью практического …
Абсолютные противопоказания
Перечень медицинских противопоказаний к проведению профилактических прививок*
Указанные в таблице состояния встречаются реже, чем у 1% детей
Вакцина | Противопоказания |
Все вакцины | Сильная реакция или поствакцинальное осложнение на предыдущее введение Непереносимость компонента вакцины, выражающаяся в тяжелых системных аллергических или анафилактических реакциях (см. Приложение 1) |
Все живые вакцины, в т.ч. оральная полиомиелитная вакцина (ОПВ) | Иммунодефицитное состояние (первичное подтвержденное) Иммуносупрессия, злокачественное новообразование Беременность Лактация (только для краснушной вакцины) |
БЦЖ | Масса тела ребенка при рождении менее 2000 г Келоидный рубец после предыдущей вакцинации Генерализованная БЦЖ-инфекция, выявленная у других детей в семье ВИЧ-инфекция с обнаружением нуклеиновых кислот ВИЧ-инфекция у матери, не получавшей трехэтапную химиопрофилактику |
АКДС (цельноклеточная) | Прогрессирующее заболевание нервной системы Афебрильные судороги в анамнезе Возраст старше 3 лет 11 мес 29 дней |
Живая коревая вакцина (ЖКВ), живая паротитная вакцина (ЖПВ), краснушная вакцина, а также комбинированные ди– и тривакцины (корь-паротит, корь-краснуха-паротит) | Анафилактическая реакция на белок перепелиного яйца (кроме краснушной), аминогликозиды (см. Приложение 1) Анафилактическая реакция на белок куриного яйца (кроме краснушной), аминогликозиды (см. Приложение 1) |
Вакцина против вирусного гепатита В | Анафилактическая реакция на пекарские дрожжи (см. Приложение 1) |
Вакцины АДС, АДС-м, АД-м | Постоянных противопоказаний нет |
________________ * Клинические рекомендации по вакцинопрофилактике пневмококковой, менингококковой, гемофильной, ротавирусной инфекции у детей и заболеваний, вызванных вирусом папилломы человека, разработанных Союзом Педиатров России и утвержденных Министерством Здравоохранения РФ | |
Примечание:
– сильной реакцией считается температура выше 40°С и местная реакция в виде гиперемии и отека свыше 8 см.
– к поствакцинальному осложнению относится: анафилактический шок; ангионевротический отек, синдром Стивенса-Джонсона, Лайелла, сывороточная болезнь; энцефалит; вакциноассоциированный полиомиелит; поражение ЦНС с генерализованными или фокальными остаточными проявлениями, приводящими к инвалидности; энцефалопатия, серозный менингит, неврит, полиневрит, а также афебрильные судороги; генерализованная БЦЖ-инфекция, остеит, остеомиелит, вызванные вакциной БЦЖ; артрит хронический, вызванный вакциной против краснухи.
– иммунодефицитные состояния, как первичные, так и вторичные, не являются противопоказанием к вакцинации инактивированными вакцинами. Детей с первичным иммунодефицитом вакцинируют всеми инактивированными вакцинами в периоде ремиссии интеркуррентного заболевания. (МУ 3.3.1.1123-02. Мониторинг поствакцинальных осложнений и их профилактика).
– иммуносупрессия может наблюдаться при проведении лучевой терапии; а также при использовании преднизолона в дозе 2 мг/кг/сут п/э или per os (или 20 мг/сут детям с весом более 10 кг) в течение 14 дней и более. Таким пациентам допускается введение живых вакцин через 1 месяц и более после окончания кортикостероидной терапии.
– при противопоказании введения АКДС или АаКДС-вакцин иммунизацию продолжают дифтерийно-столбнячным анатоксином.
– АаКДС (ацелюлярная) вакцина противопоказана при развитии энцефалопатии неясной этиологии в течение 7 дней после предыдущего введения АаКДС-акцины.
Временные противопоказания
Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний являются временными противопоказаниями для проведения прививок. Плановые прививки проводятся через 1-2 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививки проводятся сразу после нормализации температуры.
Детям, получившим препараты крови, вакцинацию живыми вакцинами проводят с определенными интервалами (см. МУ 3.3.1.1095-02. 3.3.1. Вакцинопрофилактика. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок).
Вакцинация БЦЖ-м откладывается до исчезновения клинических проявлений тяжелых поражений нервной системы, тяжелых и средне-тяжелых форм гемолитической болезни новорожденных, гнойно-септических заболеваний, генерализованных кожных поражений.
Противопоказания дополнительно для отдельных вакцин
Ротавирусная вакцина (Ротатек®)
Инвагинация кишечника в анамнезе и врожденные пороки развития ЖКТ, предрасполагающие к ней; непереносимость фруктозы, недостаточность ферментов сахаразы и/или изомальтазы.
Приложение 1.
Приложение 1
Противопоказания к вакцинации при наличии у пациента гиперчувствительности к определенным компонентам вакцины
Противопоказание к вакцинации | Тяжелая аллергическая реакция |
Против гепатита В | Пекарские дрожжи |
Против гриппа, клещевого энцефалита | Белок куриного яйца, аминогликозиды |
ЖПКВ, ЖПВ, ЖКВ | Белок перепелиного яйца, гентамицин |
Тривалентная вакцина против кори, краснухи, паротита | Белок куриного яйца, аминогликозиды, желатин |
Инактивированная вакцина против полиомиелита | Стрептомицин, полимиксин В, неомицин |
Живая пероральная вакцина против полиомиелита | Канамицин |
Против желтой лихорадки | Белок куриного яйца, аминогликозиды |
Некоторые комбинированные вакцины против коклюша, дифтерии, столбняка, полиомиелита, гепатита В | Неомицин, полимиксин |
Вакцины в форме шприц-дозы | Латекс |
Потенциальные риски инфекционных болезней в сравнении с теоретической частотой поствакцинальных осложнений (в пересчете на 1000)
Вакцина | Осложнение от инфекционного заболевания | Частота развития (на 1000 случаев заболе- | Осложнения на прививку | Частота развития (на 1000 введенных доз вакцины) | Кратность различия | |
БЦЖ | Смерть от туберкулеза | 375 | Гнойный лимфаденит | 0,1-1 | ~750 | |
Генерализованный БЦЖит | 0,001-0,03 | ~25000 | ||||
БЦЖ-остеит | 0,01 | 37500 | ||||
АКДС | Коклюш | Смерть | 10-40 среди детей до 4 лет | |||
Пневмония | 100 | Коллаптоидная реакция | 0,057-0,25 | |||
Судороги | 20 | Фебрильные судороги | 0,08-0,6 | ~70 | ||
Афебрильные судороги | 0,06 | 333 | ||||
Энцефало- | 4 | Энцефалопатия | 0,0003- | ~7000 | ||
Пронзительный крик (>3 ч) | 35 | |||||
Дифтерия | Смерть | 100-200 | Анафилактический шок | 0-0,001 | ~150000 | |
Столбняк | Смерть | 170-428 | ~300000 | |||
АС, АДС | Дифтерия | Смерть | 100-200 | Неврит плечевого нерва | 0,005-0,01 | ~20000 |
Анафилактический шок | 0,0004-0,01 | ~200000 | ||||
Столбняк | Смерть | 170-428 | Асептический абсцесс | 0,006-0,01 | ~40000 | |
Против гепатита В | Смерть | 100 | Анафилактический шок | 0,001- | ~60000 | |
Хронический гепатит В | 5-10 | ~5000 | ||||
300-500 у детей, инфициро- | ~270000 | |||||
Цирроз/Рак печени | 150-250 | ~150000 | ||||
Против полиомиелита | Смерть | 0,5-1 50-300 при парали- | ОПВ*: | 0,0003- 0,0013 | ~2000; ~500 | |
Вялый паралич | До 10 | ~28500; ~7000 | ||||
ИПВ* | Нет | |||||
Против пневмококковой инфекции | Смерть от пневмонии | 50-100 | Анафилактическая реакция** | Не доказано на сегодняшний день | ||
Смерть от сепсиса | 200 | Коллаптоидная реакция** | Не доказано на сегодняшний день | |||
Смерть от менингита | 250-300 | |||||
Против кори, паротита, краснухи | Смерть | Корь | 2-100 | |||
Паротит | 5-15 | |||||
Краснуха | 0,1-10 | |||||
Энцефа- | Корь | 0,5-1 4-6 | Энцефаломиелит | 0,001 | ~3000 | |
Паротит | 0,2-3 | ~1500 | ||||
Краснуха | 0,2 | ~200 | ||||
Энцефалопатия | 3,3 | Энцефалопатия | 0,001 | 3000 | ||
Тромбоцитопения | 3,3 | Тромбоцитопения | 0,025- | ~120 | ||
Пневмония | 50-100 | Анафилактический шок | 0,001- | ~35000 | ||
Глухота | 0,05 | ~30 | ||||
Против ветряной оспы | Смерть | 0,01-0,02 | ||||
Менингоэнцефалит | 2 | Менингоэнцефалит | 0,002 | ~1000 | ||
Опоясывающий герпес в старш.возр. | 100-200 | ~75000 | ||||
Пневмония, бронхит | 200 | ~100000 | ||||
Стрептодермия | 450 | ~225000 | ||||
ВПЧ-вакцина*** | Рак шейки матки | У 50-100 инфициро- | Анафилактическая реакция | 0,002 0,0017- | ~37500 | |
Сокращения: * ОПВ – оральная полиомиелитная вакцина (живая ослабленная); ИПВ – инактивированная (убитая) полиомиелитная вакцина ** Для 13-валентной пневмококковой конъюгированной вакцины, предназначенной для обеспечения Национального календаря профилактических прививок РФ *** Вакцина против вируса папилломы человека, вызывающего рак шейки матки и другие виды злокачественных заболеваний генитальной области Источники (адаптировано из): Специалисты о прививках, интернет-ресурс при поддержке МЗ РФ, ссылка: https://www.yaprivit.ru/o-vaccinah/ Лакоткина Е.А., Харит С.М., Черняева Т.В., Брусов Н.К. Поствакцинальные осложнения (клиника, диагностика, лечение, профилактика). – Пособие практического врача, СПб: Санкт-Петербургский медицинский информационно-аналитический центр, 2004. – 79 с. А.Н.Мац (НИИ вакцин и сывороток им.И.И.Мечникова РАМН) – Врачам об антипрививочном движении и его вымыслах в СМИ. WHO Global Vaccine Safety Essential Medicines & Health Products 20, Avenue Appia, CH-1211 Geneva 27 Switzerland. Information Sheet observed rate of vaccine reactions Diphteria, Pertussis, Tetanus Vaccines. May 2014. https://www.who.int/vaccine_safety/initiative/tools/DTP_vaccine_rates_information_sheet.pdf?ua=1 Позиция ВОЗ по вакцинам, ссылка: https://www.who.int/immunization/documents/positionpapers/ru/ Инструкция по применению 13-валентной пневмококковой конъюгированной вакцины ЛП-000798-041016 Учебное пособие ВОЗ по основам безопасности вакцин, 2015 г. ссылка: https://www.euro.who.int/_data/assets/pdf_file/0007/292759/Vaccine-safety-messages-ru.pdf. Нервные болезни. Учебное пособие. Под ред. Яроша А. А. – 1985.- 483 с. | ||||||
Электронный текст документа
подготовлен АО “Кодекс” и сверен по:
официальный сайт Минздрава России
www.rosminzdrav.ru
по состоянию на 01.08.2019
Источник
–
15 2021. N1//1-155 ” COVID-19 ”
15 2021. N1//1-155 ” COVID-19 “
, COVID-19, G SARS-CoV-2 .
, G SARS-CoV-2, , .
– ( -) SARS-CoV-2 ( 14 ), – 14 .
: 25 . 1 .
__________________________
“____” _________________ 202 .
2021.
1.
( ), , COVID-19 ; .
, – COVID-19 -18 ( ).
2.
:
– 17.07.1998 N157- ” “;
– 21.11.2011 N323- ” “;
– 12.04.2010 N61- ” “;
– 16.04.2012 N291 ” ( , , , “”)”;
– 15.05.2012 N543 ” – “;
– 31 2020. N373 ” (COVID-19)”;
– 03.12.2020 N41 ” – 3.1.3671-20 ” (COVID-19) –“;
– 03.03.2008 N15 ” – 3.3.2342-08″ ( ” 3.3.2342-08. . – “);
– 15.02.2017 N1071 ” “;
– ” , “, 12.04.2019.
3. ,
3.1. :
3.2. :
4.
“–” , SARS-CoV-2, . : I II. I 26 , S- SARS-CoV-2, II 5 , S SARS-CoV-2. 18. . : . , SARS-CoV-2.
: 6 . .
5. , “–”
“–” , , .
, , .
, , .
, “–“, .
“–” – , . .
, “–” .
.
“–” , . .
:
– ( );
– ( );
– -, ( ).
, “–” .
, “–” , , , , , – , 4.
.
– , , .
, (, ), , .
“–” , , .
“–” .
“–” , , , . , () “–“, ( 18 ) .
“–” , ” ” , , ” ” . 3.3.2.3332-16.
6.
ID-19 “–” ( – ) , , , ID-19 ( N1). , () “”.
: (COVID-19) 18 .
:
– – , ;
– ;
– , – 2-4 . , ;
– ;
– 18 ( ).
II:
– ( , , , 40 ..) I .
:
, ( ), , , , , , .
:
– ( , , );
– .
.
, , 20 2012. N 1079 ” ).
: , 37, .
:
1) , , .
2) , , IgM IgG -, S- RBD S- SARS-CoV-2 , 42 I .
7.
( N2). ( N3). ( 14 ), – 14 , : – ( -) SARS-CoV-2. COVID-19 , G SARS-CoV-2, .
, . I , , , , , – , .
( N5).
, ( 20 2012. N 1079 ” “).
– (0,5 / ) (3,0 ). 30 . , 3,0 , , 5 0,5 . 3,0 2 . 0,5 .
I II . : , , !
, . . , . . 2.0 , 0,5 , . ( ) .
. . ( ). – .
: I 0,5 , 21 II 0,5 .
30 !
– ( , , , , , , , ) ( , , ) . , , , – .
, , .
II ( 21 I ), II , , , , , – , .
II.
II I .
30 !
I II COVID-19 .
8.
“–” , , . I II COVID-19 .
15.02.2017 N1071 ” ” .
” , ” ( 12.04.2019).
() () : (.025-87), (.156/-93), (. 064).
, , (. 060), – (.110/) (. 003-1/).
(), , , () :
– , , ;
– () (), , .
() (), , , , , :
– 2 (, ) () , – ; () ;
– ;
– 12 – ( ) (), , :
– () , – ( 04.02.2016 N11 ” – “;
– “” ( ).
, , , .
, , , , :
– ,
– /
– /
– , , , , .
– ()
– /
– , , , , , ,
– , ,
.
() ( ), , (, , , , .), , , () ().
( – ), ().
( 1 # ” , , 12.04.2019)), ( 6 ).
– (, , -, ) .
() , , ( ) ( ” 2.0″ ), .
, 12.04.2010 N 61- ” “.
N1
, COVID-19
( “–“)
N2
N3
OVID-19 “–“
!
– ! , , ( ) , :
1. , VID-19 G SARS-CoV-2 .
2. :
– – , ;
– ;
– ;
– ( 2-4 );
– ;
– 18 .
3. , , , – .
.
4. : I 0,5 . . 21 II 0,5 . .
5. 30 .
6. ( 1 2 ) – ( , , , , , , , ) ( , , ) .
, , , – . .
3- , , , , .
, , . – .
COVID-19 , .
N4
OVID-19
:
VID-19 ()
__________________________ ________________________________
N5
“–” – , SRS-CoV-2
:
I (, , ) _______________________________
II (, , ) _________________________________
:
– ( , , , , , , , ) ( , , ) . , , , – . .
3- , , , , . , , . – .
COVID-19. , .
, G , , .
Источник
