Приказ 191 по прививкам

МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 27 апреля 2017 г. N 191н
ОБ УТВЕРЖДЕНИИ ПОЛОЖЕНИЯ
О СОВЕТЕ ПО ЭТИКЕ, СОЗДАННОМ В ЦЕЛЯХ ВЫДАЧИ ЗАКЛЮЧЕНИЯ
ОБ ЭТИЧЕСКОЙ ОБОСНОВАННОСТИ ВОЗМОЖНОСТИ ПРОВЕДЕНИЯ
КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ БИОМЕДИЦИНСКОГО КЛЕТОЧНОГО
ПРОДУКТА, ПОРЯДКА ЕГО ДЕЯТЕЛЬНОСТИ И ТРЕБОВАНИЙ
К КВАЛИФИКАЦИИ И ОПЫТУ РАБОТЫ ЭКСПЕРТОВ СОВЕТА ПО ЭТИКЕ
В соответствии с частями 1 и 5 статьи 14 Федерального закона от 23 июня 2016 г. N 180-ФЗ “О биомедицинских клеточных продуктах” (Собрание законодательства Российской Федерации, 2016, N 26, ст. 3849) и подпунктом 5.2.207(15) Положения о Министерстве здравоохранения Российской Федерации, утвержденного постановлением Правительства Российской Федерации от 19 июня 2012 г. N 608 (Собрание законодательства Российской Федерации, 2012, N 26, ст. 3526; 2013, N 16, ст. 1970; N 20, ст. 2477; N 22, ст. 2812; N 33, ст. 4386, N 45, ст. 5822; 2014, N 12, ст. 1296; N 26, ст. 3577; N 30, ст. 4307; N 37, ст. 4969; 2015, N 2, ст. 491; N 12, ст. 1763; N 23, ст. 3333; 2016, N 2, ст. 325; N 9, ст. 1268, N 27, ст. 4497; N 28, ст. 4741; N 34, ст. 5255; N 49, ст. 6922; 2017, N 7, ст. 1066), приказываю:
Утвердить прилагаемое Положение о совете по этике, созданном в целях выдачи заключения об этической обоснованности возможности проведения клинического исследования биомедицинского клеточного продукта, включая порядок его деятельности и требования к квалификации и опыту работы экспертов совета по этике.
Врио Министра
Д.В.КОСТЕННИКОВ
Утверждено
приказом Министерства здравоохранения
Российской Федерации
от 27 апреля 2017 г. N 191н
ПОЛОЖЕНИЕ
О СОВЕТЕ ПО ЭТИКЕ, СОЗДАННОМ В ЦЕЛЯХ ВЫДАЧИ ЗАКЛЮЧЕНИЯ
ОБ ЭТИЧЕСКОЙ ОБОСНОВАННОСТИ ВОЗМОЖНОСТИ ПРОВЕДЕНИЯ
КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ БИОМЕДИЦИНСКОГО КЛЕТОЧНОГО
ПРОДУКТА, ПОРЯДОК ЕГО ДЕЯТЕЛЬНОСТИ И ТРЕБОВАНИЯ
К КВАЛИФИКАЦИИ И ОПЫТУ РАБОТЫ ЭКСПЕРТОВ
I. Общие положения
1. Совет по этике, созданный в целях выдачи заключения об этической обоснованности возможности проведения клинического исследования биомедицинского клеточного продукта (далее – Совет по этике), является постоянно действующим органом, созданным Министерством здравоохранения Российской Федерации (далее – Министерство) для проведения этической экспертизы возможности проведения клинического исследования биомедицинского клеточного продукта (далее – этическая экспертиза).
2. Совет по этике действует в целях защиты жизни, здоровья и прав пациентов, принимающих участие в клинических исследованиях биомедицинского клеточного продукта.
3. В своей деятельности Совет по этике руководствуется Конституцией Российской Федерации, федеральными законами, указами и распоряжениями Президента Российской Федерации, постановлениями и распоряжениями Правительства Российской Федерации, приказами Министерства, нормами международного права и настоящим Положением.
4. Основными принципами деятельности Совета по этике являются независимость, гласность, справедливость, соблюдение прав и свобод человека и гражданина, прав юридических лиц, объективность, компетентность, ответственность экспертов за проведение и качество этической экспертизы.
5. Основными задачами Совета по этике являются:
1) проведение этической экспертизы документов, связанных с проведением клинического исследования биомедицинского клеточного продукта;
2) подготовка заключения об этической обоснованности возможности или невозможности проведения клинического исследования биомедицинского клеточного продукта.
6. Совет по этике в соответствии с возложенными на него задачами имеет право:
1) получать документы, необходимые для проведения этической экспертизы;
2) запрашивать у Министерства материалы, необходимые для проведения этической экспертизы.
II. Порядок формирования Совета по этике
7. Персональный состав Совета по этике утверждается приказом Министерства.
8. Состав Совета по этике формируется из представителей общественных организаций, медицинских, научных и образовательных организаций, а также заинтересованных федеральных органов исполнительной власти (далее – эксперты). Количество представителей медицинских и научных организаций составляет не более половины от общего числа экспертов. Общее число членов Совета по этике не может превышать 15 человек.
9. Изменения в состав Совета по этике вносятся приказом Министерства.
10. Состав Совета по этике состоит из председателя Совета по этике, двух заместителей председателя Совета по этике, ответственного секретаря Совета по этике и членов Совета по этике.
11. Председатель Совета по этике назначается Министром здравоохранения Российской Федерации из числа экспертов Совета по этике, имеющих высшее медицинское образование, ученую степень кандидата медицинских наук или доктора медицинских наук и опыт работы по проведению клинических исследований биомедицинских клеточных продуктов или лекарственных препаратов для медицинского применения и разрешению вопросов, связанных с этическими аспектами клинических исследований биомедицинских клеточных продуктов или лекарственных препаратов для медицинского применения.
12. Председатель Совета по этике осуществляет общее руководство, определяет направления работы Совета по этике, организует его работу, распределяет обязанности между экспертами Совета по этике, осуществляет контроль за проведением этической экспертизы.
В отсутствие председателя Совета по этике обязанности председателя исполняет один из его заместителей.
13. В составе Совета по этике могут создаваться при необходимости экспертные группы. Состав и положение об экспертных группах утверждаются председателем Совета по этике.
III. Требования к квалификации и опыту работы экспертов
14. К членам Совета по этике предъявляются следующие требования:
1) для лиц, имеющих высшее медицинское образование, – наличие сертификата специалиста;
2) для иных лиц:
а) наличие высшего образования;
б) наличие опыта работы и знаний в области этических и правовых аспектов защиты прав и свобод гражданина.
IV. Порядок деятельности Совета по этике
15. Заседания совета по этике проводятся председателем Совета по этике или по его поручению заместителем председателя Совета по этике по мере необходимости и оформляются протоколом, который подписывается председательствующим на заседании Совета по этике или его заместителем.
16. Заседание Совета по этике считается правомочным, если на нем присутствует не менее двух третей его членов.
17. На первом заседании Совета по этике определяется порядок проведения заседаний Совета по этике и регламент работы Совета по этике.
18. Материалы к очередным заседаниям Совета по этике направляются экспертам Совета по этике департаментом Министерства, ответственным за организационно-техническое обеспечение Совета по этике, не позднее чем за три рабочих дня до назначенного срока заседания.
19. Эксперт Совета по этике обязан участвовать в его работе и присутствовать на заседаниях Совета по этике либо в случае невозможности по уважительной причине присутствовать на заседании заблаговременно проинформировать председателя Совета по этике или/и его заместителя. Эксперты Совета по этике участвуют в его работе лично, делегирование полномочий не допускается.
20. Эксперты Совета по этике, участвующие в планируемом клиническом исследовании биомедицинского клеточного продукта, не привлекаются к этической экспертизе.
21. Решение Совета по этике принимается открытым голосованием простым большинством голосов присутствующих на заседании.
22. Эксперты Совета по этике, участвующие в планируемом клиническом исследовании биомедицинского клеточного продукта, к голосованию по результатам этической экспертизы не допускаются.
23. Эксперты Совета по этике, находящиеся в зависимости от заявителя или заинтересованные в результатах этической экспертизы, должны заявить об этом председателю Совета по этике или лицу, его замещающему. В этом случае данные эксперты Совета по этике не участвуют в заседании Совета по этике и не участвуют в голосовании.
24. В случае равенства голосов решающим является голос председательствующего на заседании Совете по этике.
25. Решения Совета по этике оформляются протоколом заседания Этического комитета, к которому прилагается заключение, которые подписываются председателем Совета по этике или заместителем председателя Совета по этике, председательствовавшим на заседании, членами Совета по этике, принимавшими участие в рассмотрении.
26. Эксперт Совета по этике, не согласный с принятым решением, имеет право в письменной форме изложить особое мнение, которое прилагается к протоколу заседания Совета по этике и является его неотъемлемой частью.
27. Информация о составе совета по этике, планах его работы и текущей деятельности размещается на официальном сайте Министерства в информационно-телекоммуникационной сети “Интернет” в установленном им порядке. <*>
——————————–
<*> Часть 6 статьи 14 Федерального закона от 23 июня 2016 г. N 180-ФЗ “О биомедицинских клеточных продуктах” (Собрание законодательства Российской Федерации, 2016, N 26, ст. 3849).
Источник
Зарегистрировано в Минюсте России 16 декабря 2020 г. N 61502
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 9 декабря 2020 г. N 1307н
О ВНЕСЕНИИ ИЗМЕНЕНИЙ В КАЛЕНДАРЬ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК ПО ЭПИДЕМИЧЕСКИМ ПОКАЗАНИЯМ, УТВЕРЖДЕННЫЙ ПРИКАЗОМ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОТ 21 МАРТА 2014 Г. N 125Н
В соответствии со статьями 10 и 11 Федерального закона от 17 сентября 1998 г. N 157-ФЗ “Об иммунопрофилактике инфекционных болезней” (Собрание законодательства Российской Федерации, 1998, N 38, ст. 4736; 2013, N 48, ст. 6165) приказываю:
Внести изменения в календарь профилактических прививок по эпидемическим показаниям, утвержденный приказом Министерства здравоохранения Российской Федерации от 21 марта 2014 г. N 125н (зарегистрирован Министерством юстиции Российской Федерации 25 апреля 2014 г., регистрационный N 32115), с изменениями, внесенными приказами Министерства здравоохранения Российской Федерации от 16 июня 2016 г. N 370н (зарегистрирован Министерством юстиции Российской Федерации 4 июля 2016 г., регистрационный N 42728), от 13 апреля 2017 г. N 175н (зарегистрирован Министерством юстиции Российской Федерации 17 мая 2017 г., регистрационный N 46745), от 19 февраля 2019 г. N 69н (зарегистрирован Министерством юстиции Российской Федерации 19 марта 2019 г., регистрационный N 54089), от 24 апреля 2019 г. N 243н (зарегистрирован Министерством юстиции Российской Федерации 15 июля 2019 г., регистрационный N 55249) и от 14 сентября 2020 г. N 967н (зарегистрирован Министерством юстиции Российской Федерации 12 октября 2020 г., регистрационный N 60329), следующие изменения:
а) дополнить позицией следующего содержания:
“
| Против коронавирусной инфекции, вызываемой вирусом SARS-CoV-2 | К приоритету 1-го уровня относятся: взрослые, работающие по отдельным профессиям и должностям: работники медицинских, образовательных организаций, социального обслуживания и многофункциональных центров); лица, проживающие в организациях социального обслуживания; лица с хроническими заболеваниями, в том числе с заболеваниями бронхолегочной системы, сердечно-сосудистыми заболеваниями, сахарным диабетом и ожирением. К приоритету 2-го уровня относятся: взрослые, работающие по отдельным профессиям и должностям: работники организаций транспорта и энергетики, сотрудники правоохранительных органов, государственных контрольных органов в пунктах пропуска через государственную границу; лица, работающие вахтовым методом; волонтеры; военнослужащие; работники организаций сферы предоставления услуг. К приоритету 3-го уровня относятся: государственные гражданские и муниципальные служащие; обучающиеся в профессиональных образовательных организациях и образовательных организациях высшего образования старше 18 лет; лица, подлежащие призыву на военную службу. |
б) порядок проведения гражданам профилактических прививок в рамках календаря профилактических прививок по эпидемическим показаниям дополнить пунктом 8 следующего содержания:
“8. С учетом эпидемической ситуации по решению исполнительных органов государственной власти субъектов Российской Федерации при вакцинации против коронавирусной инфекции уровни приоритета могут быть изменены.”.
Министр
М.А. МУРАШКО
Источник
20 2021. N1//1-1221 ” — COVID-19 “
” — COVID-19 “.
.
: 43 . 1 .
” — COVID-19 “
COVID-19 ( ” ” ) , “”.
1.
1.1. COVID-19 .
1.2. , , COVID-19 , COVID-19 .
1.3. , – , ” ( )” .
2. COVID-19
2.1. COVID-19 – , , , , () ” ( )”.
2.2. COVID-19 , , .
2.3. COVID-19 . , – , . , () ” ( )”.
2.4. COVID-19 . COVID-19 , , , , , ” “.
2.5. .
2.6. , , , ( ), , ” ” , .
2.7. COVID-19 “–” ( – ), , , , .
2.8. .
2.9. : (COVID-19) 18 .
2.10. :
– – , ;
– ;
– , – 2-4 . , ;
– ;
– 18 ( ).
2.11. II:
– ( , , , 40 ..) I .
2.12. : , ( ), , , , , , .
2.13. :
– ( , , );
– .
2.14. : , , . , , , , 1 – .
2.15. .
2.16. 3.02.2021. N47 ” , 21 2014. N125″.
3.
3.1. , .
4.
4.1. – .
4.2. :
– (, );
– (, , );
– ;
– COVID-19.
5. COVID-19
5.1. COVID-19 , , , . .
5.2. COVID-19 , , , , , 20 21.11.2011 N323- ” ” ( N1), ( N3).
5.3. (, -) , , ( ), , , , – , COVID-19 ( N1). ( N2).
5.4. , (, -) .
5.5. COVID-19 , , .
5.6. ( 18Ѱ) , , , , .
5.7. I II . 3,0 . 0,5 . : , !
5.8. . .
5.9. ( ), – ). .
5.10. ().
5.11. “–” , . I II COVID-19 .
6. COVID-19
6.1. , , , , , COVID-19 *.
6.2. COVID-19 ( ):
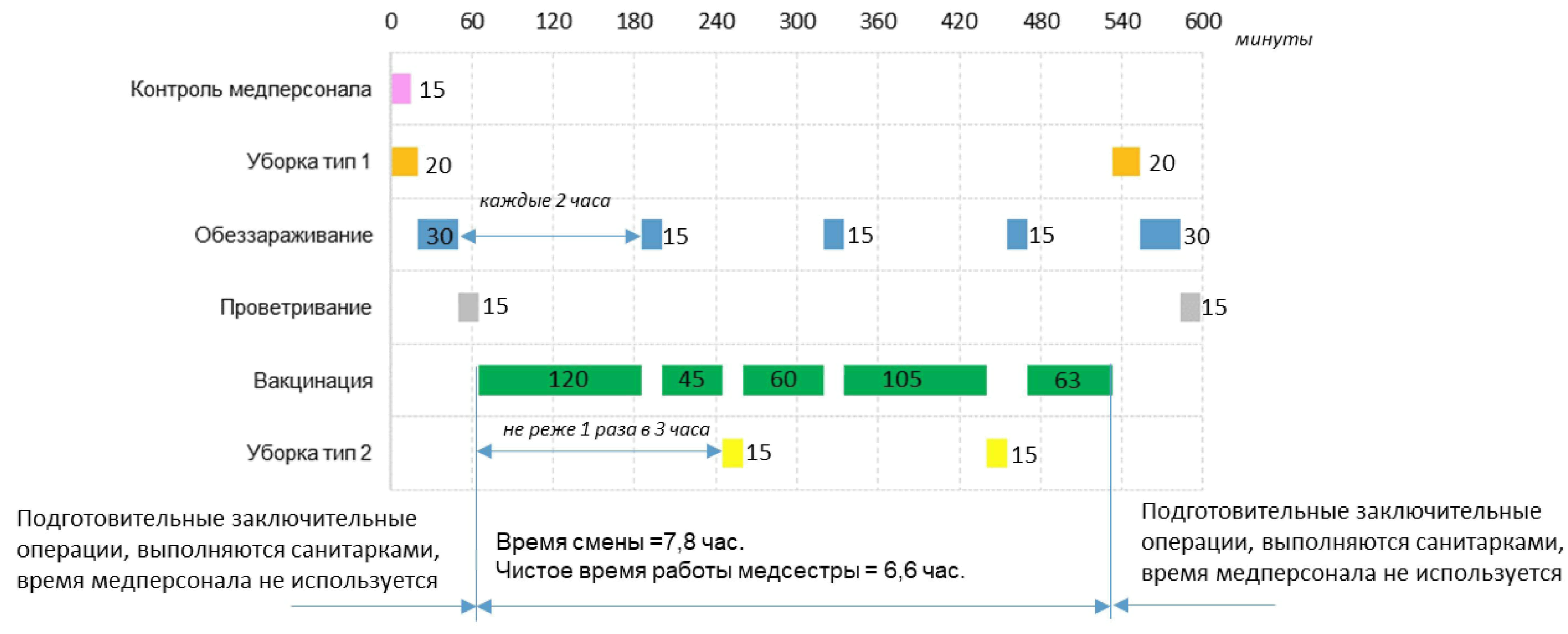
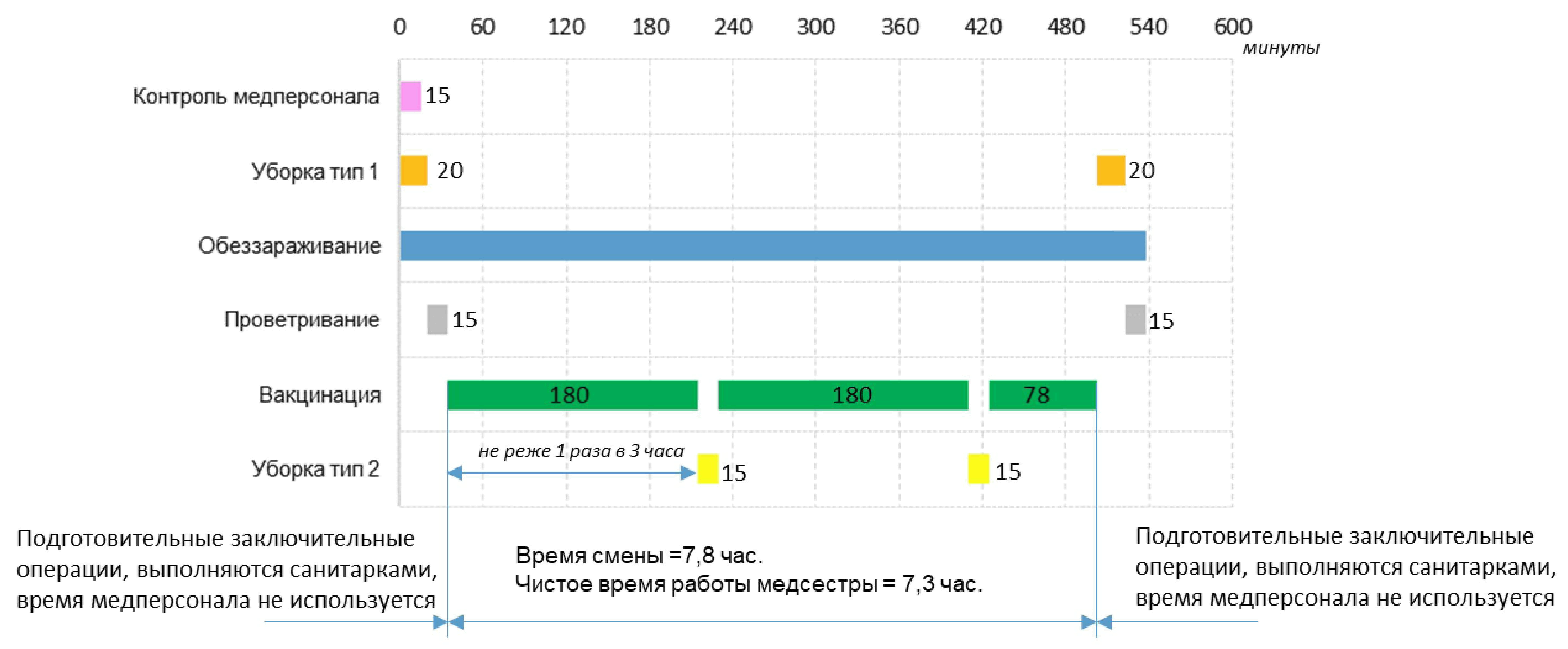
6.3. COVID-19 ( N4) .6.2 ( N5). , , .
6.4. COVID-19 ( N6)
6.5. , , N7. N7 .
6.6 N8.
7. COVID-19
7.1. , , , , , COVID-19 .
7.2. COVID-19 ( ):
7.3. , , .
7.4. , .
7.5. , , , .
7.6. COVID-19 ().
7.7. :
– VID-19 ;
– , ;
– , ;
– , , , ( ) ;
– ;
– , , ;
– , – ;
– .
8.
8.1. – (0,5/ ) (3,0 ). , 3,0 , , 5 0,5. 3,0 2 . 0,5 . 0,5 .
8.2. I II . : , , !
8.3. , . . , . . 2,0 , 0,5 , . ( ) .
8.4. . . ( ). – .
8.5. : I 0,5, 21 II 0,5 .
9.
9.1. 15.02.2017 N1071 ” ” .
9.2. ” , ” ( 12.04.2019).
9.3. () (, -) : (. 025-87), (.156/-93), (. 064).
9.4. , , (. 060), – (.110/) (. 003-1/).
9.5. (), , , () :
– , , ;
– () (), , .
9.6. () (), , , , , :
– 2 ( , , , , ), , – ; () ;
– ;
– 12 – ( ) (), , :
– () , – ( 04.02.2016 N11 ” – “;
– “” ( ).
9.7. , , , .
9.8. , , , , :
– ,
– /
– /
– , , , , .
– ()
– –
– /
– , , , , , ,
– , ,
9.9. () ( ), , (, , , , .), , , () ().
9.10. ( – ), ().
9.11. ( 1 ” , “, 12.04.2019)), ( 6 ).
9.12. – (, , -, ) .
9.13. () , , ( ) ( ” 2.0″ ), .
9.14. , 12.04.2010 N61- ” “.
10. , “–“
10.1. “–” , , .
10.2. , , .
10.3. , , .
10.4. , “–“, .
10.5. “–” – , . .
10.6. , “–” .
10.7. .
10.8. “–” , . .
10.9. :
– ( );
– ( );
– -, ( ).
10.10. , “–” .
10.11. , “–” , , , , , – , 4.
10.12. .
10.13. – , , .
10.14. , (, ), , .
10.15. “–” , , .
10.16. ” ” “–” .
10.17. “–” , , , . , () “–“, ( 18 ) .
10.18. “–” , ” ” , , ” ” . 3.3.2.3332-16.
10.19. ( ).
11. /
11.1. – , .
11.2. / , ().
11.3. / , , .
11.4. / , , .
11.5. . . . , , , , .
11.6. . .
11.7. :
– , ;
– ;
– ;
– ;
– / ;
– ;
– .
11.8. / () .
11.9. , /, .
11.10. / : ( ), , /. , . , , .
11.11. . / , . , , .
12.
– 17.07.1998 N157- ” “;
– 21.11.2011 N323- ” “;
– 12.04.2010 N61- ” “;
– 16.04.2012 N291 ” ( , , , “”)”;
– 15.05.2012 N543 ” – “;
– 31 2020. N373 ” (COVID-19)”;
– 03.03.2008 N15 ” – Ϡ3.3.2342-08″ ( ” 3.3.2342-08. . – “);
– 04.06.2008 N34 ” – Ϡ3.3.2367-08″ ( “Ϡ3.3.2367-08. . – “);
– 3 2020. N41 ” – Ϡ3.1.3671-20 ” (COVID-19) –“;
– 03.04.2020 N440 ” 2020 “
– 16.04.2012 N291 ” ( , , , “”)”
– /
– ” , “, 12.04.2019;
– 15.02.2017 N1071 ” “.
– 3.02.2021. N47 ” , 21 2014 . N125″.
13. , ,
N1
( )
, () __________________________________________________________
( )
: __________________________________________________________________________
( , )
: _______________________________________________________________________________
, :
– ;
– ( , , , , , ):
– , – ;
– , , (, , , ) ( , , ): (, ), , , ;
– :
– () , , . , , , . ( ) .
() () .
, , , , :
_______________________ “____” ____________ 2021
( )
_______________________ “____” ____________ 2021
( )
, , .
_____________________________________ ___________________
(, , ) ()
( )
_____________
: ________________
COVID-19
: COVID-19
()
______________________ _______________________
N2
“–” – , SARS-CoV-2
:
I (, , ) ____________________
II (, , ) ____________________
:
– ( , , , , , , , ) ( , , ) . , , , – . .
3- , , , , . , , . – .
3 . – .
N3
COVID-19 “–“
!
– ! , , ( ) , :
1. , COVID-19 G SARS-CoV-2 .
2. :
– – , ;
– ;
– ;
– ( 2-4 );
– ;
– 18 .
3. , , , – .
.
4. : I 0,5. . 21 II 0,5. .
5. 30 .
6. ( I II ) – ( , , , , , , , ) ( , , ) .
, , , – . .
3- , , , , .
, , . – .
COVID-19 , .
N4
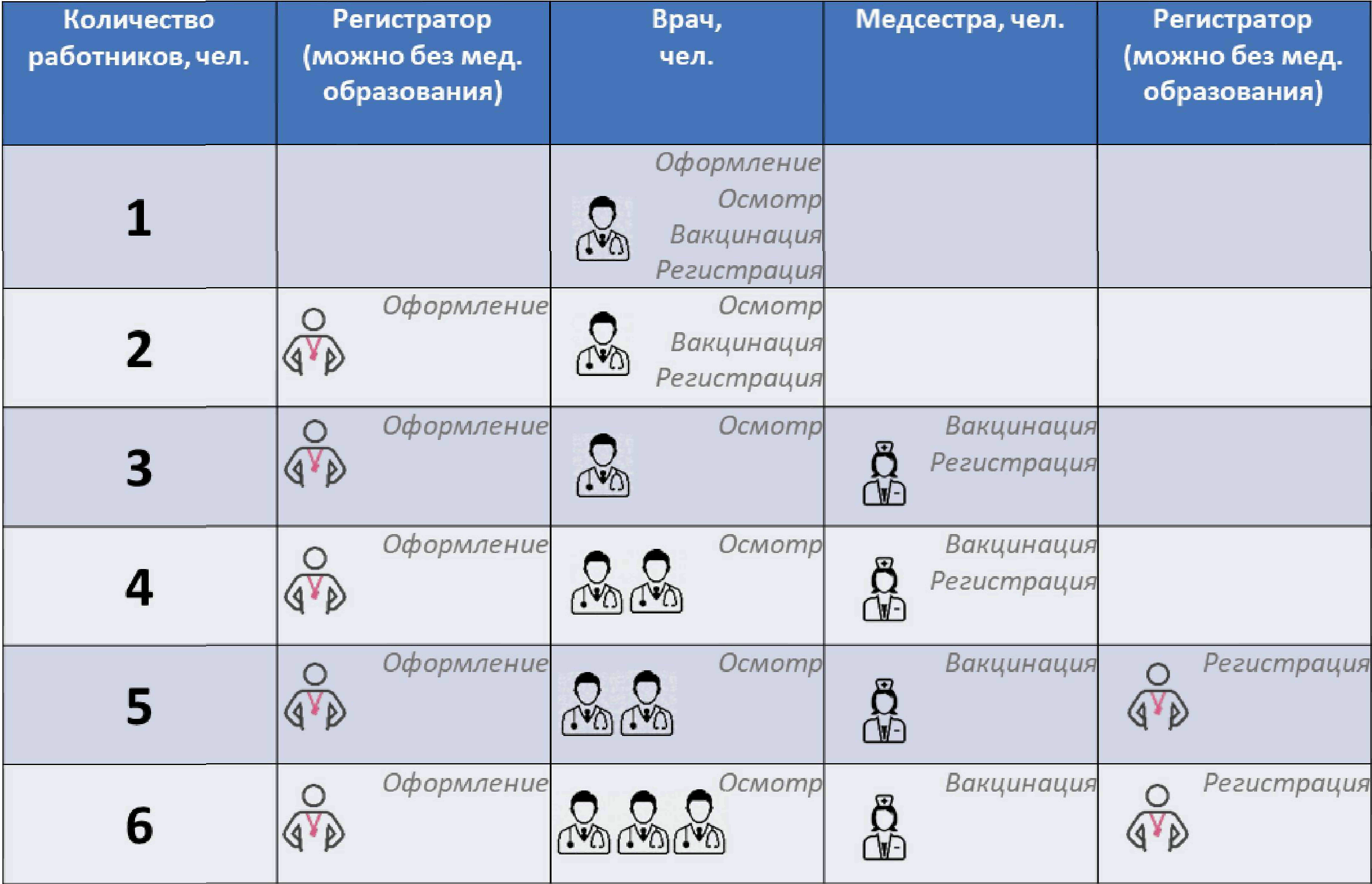
N5
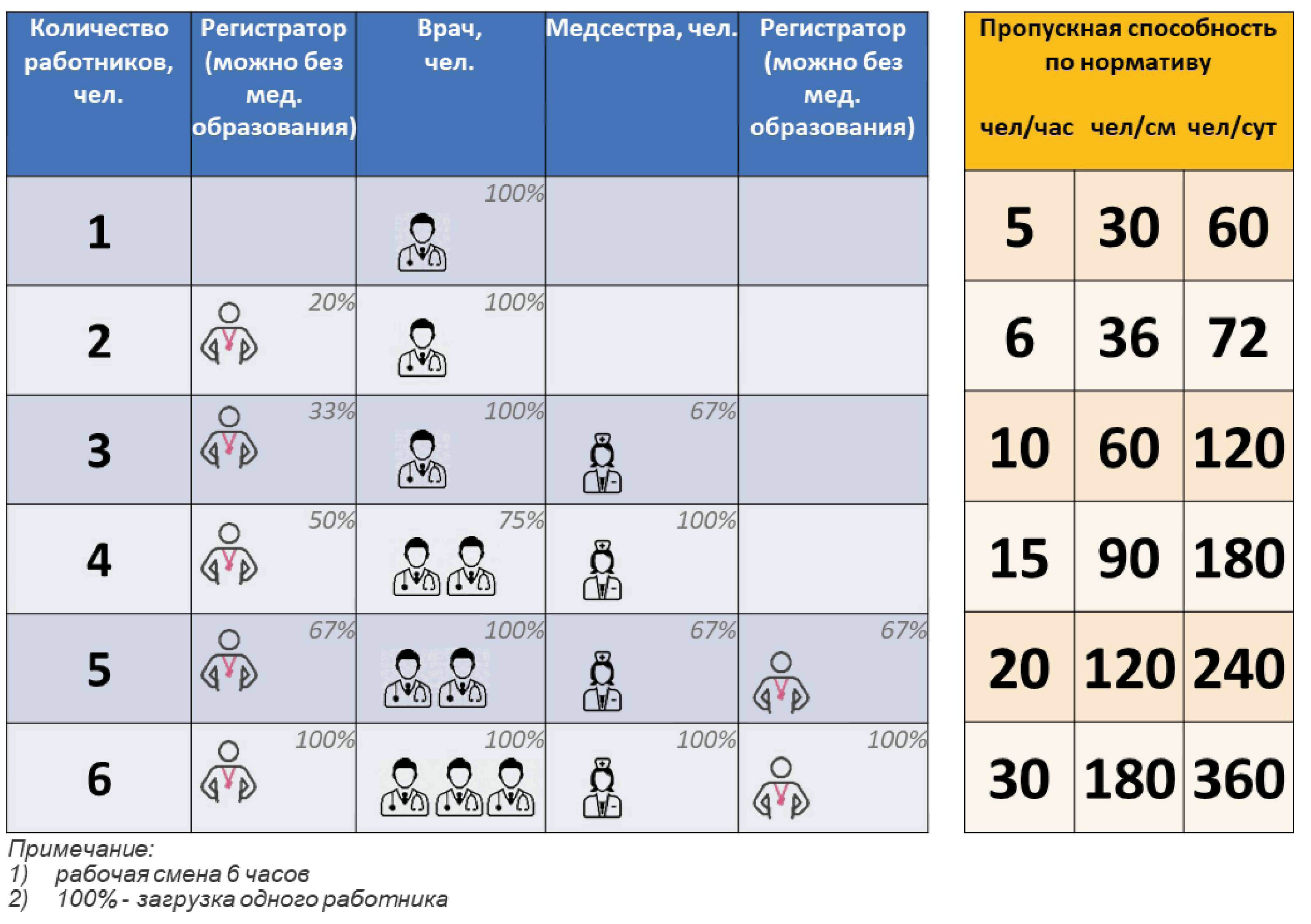
N6

N6
N6
N7

:
(, ..)
N7
N7
:
N8
– , ” “
–
–
–
– ” “
– – ” “
– “”
– “”
– “”
– “”
COVID-19 –. . , . .
Источник
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ВЕТЕРИНАРНОМУ И ФИТОСАНИТАРНОМУ НАДЗОРУ
ПРИКАЗ
от 19 апреля 2012 года N 191
О лицензировании фармацевтической деятельности
(с изменениями на 18 мая 2012 года)
Информация об изменяющих документах
____________________________________________________________________
Документ с изменениями, внесенными:
приказом Россельхознадзора от 18 мая 2012 года N 254.
____________________________________________________________________
В целях определения полномочий центрального аппарата Федеральной службы по ветеринарному и фитосанитарному надзору и территориальных управлений Федеральной службы по ветеринарному и фитосанитарному надзору при осуществлении лицензирования в соответствии с Положением о лицензировании фармацевтической деятельности, утвержденным постановлением Правительства Российской Федерации от 22.12.2011 N 1081, и на основании пункта 4 Положения о Федеральной службы по ветеринарному и фитосанитарному надзору, утвержденного постановлением Правительства Российской Федерации от 30.06.2004 N 327,
а) центральный аппарат Федеральной службы по ветеринарному и фитосанитарному надзору лицензирует фармацевтическую деятельность в сфере обращения лекарственных средств для ветеринарного применения (по результатам проверок территориальными управлениями возможности соблюдения соискателями лицензий и лицензиатами лицензионных требований и условий):
– организаций оптовой торговли лекарственными средствами для ветеринарного применения;
– ветеринарных аптечных организаций, осуществляющих свою деятельность на территории двух или более субъектов Российской Федерации;
– индивидуальных предпринимателей, осуществляющих свою деятельность на территории двух или более субъектов Российской Федерации;
– ветеринарных организаций федеральных органов исполнительной власти;
б) территориальные управления Федеральной службы по ветеринарному и фитосанитарному надзору лицензируют розничную торговлю лекарственными препаратами, их хранение, перевозку, отпуск и изготовление, если места осуществления деятельности расположены в регионе деятельности одного территориального управления Россельхознадзора при осуществлении деятельности:
– ветеринарными организациями;
– ветеринарными аптечными организациями;
– индивидуальными предпринимателями;
в) территориальные управления Федеральной службы по ветеринарному и фитосанитарному надзору лицензируют фармацевтическую деятельность в сфере обращения лекарственных препаратов для ветеринарного применения:
– ветеринарных аптечных организаций и индивидуальных предпринимателей, осуществляющих свою деятельность на территории одного субъекта Российской Федерации;
– ветеринарных организаций и организаций, осуществляющих разведение, выращивание и содержание животных;
г) территориальные управления Федеральной службы по ветеринарному и фитосанитарному надзору лицензируют розничную торговлю лекарственными препаратами, их хранение, перевозку, отпуск и изготовление, если места осуществления деятельности расположены в регионе деятельности одного территориального управления Россельхознадзора, хранение лекарственных препаратов в ветеринарных организациях и организациях по разведению, выращиванию и содержанию животных.
3. Контроль за выполнением настоящего приказа возложить на заместителя Руководителя Федеральной службы по ветеринарному и фитосанитарному надзору Е.А.Непоклонова.
Руководитель
С.А.Данкверт
Редакция документа с учетом
изменений и дополнений подготовлена
Источник
