Прививка гриппол плюс делать или нет ребенку 3 года

Грипп у детей с хроническими заболеваниями
У детей больных астмой, хроническими легочными заболеваниями грипп приводит к обострению, приступам затруднения дыхания и осложняется пневмонией. Грипп у детей с неврологической патологией сопровождается тяжелыми расстройствами дыхания, нередко с летальным исходом. У больных с заболеваниями сердца он приводит к сердечной недостаточности. Грипп вызывает обострение сахарного диабета, муковисцидоза и многих других и без того тяжелых болезней.
Каким детям необходима прививка?
Среди детей есть определенные категории, которые нуждаются в прививке от гриппа в первую очередь:
- дети, часто болеющие простудными заболеваниями, с хроническими заболеваниями дыхательной системы;
- дети с хроническими заболеваниями других органов и систем;
- дети, посещающие школу и дошкольные учреждения, контактирующие со сверстниками.


Новорожденные и младенцы до 6 месяцев
Иммунитет детей первых месяцев жизни в основном обеспечивается пассивным материнским иммунитетом, то есть антитела против вирусов передаются от матери ребенку. Таким образом у новорожденных детей отсутствует собственный иммунитет, что значительно повышает риск заболевания гриппом. Ситуация осложняется тем, что из-за отсутствия собственных антител, вакцины от гриппа в возрасте до шести месяцев не эффективны. Поэтому для семей, которые ждут малыша, необходима обязательная профилактика гриппа у будущих родителей, а именно:
Для защиты новорожденного, женщина должна быть вакцинирована против гриппа во 2-м или 3-м триместре беременности. Пройдя вакцинацию во время беременности, будущая мама передаст трансплацентарные антитела новорожденному, надежно защитив его от гриппа в первые 6 месяцев жизни. Это очень важно, так как для таких малышей еще не существует прививок против гриппа, а прием противовирусных препаратов может быть опасным как для самой женщины, так и для новорожденного малыша.
Все кто контактирует с ребенком, должны быть привиты от гриппа (как медицинский персонал, так и члены семьи).
При малейшем проявлении острой респираторной инфекции у кого-либо из членов семьи, ни в коем случае нельзя допускать его контакта с ребенком.
Как уберечь ребенка от гриппа?
Вакцинация является безальтернативным способом защиты детей от тяжелых последствий гриппа в возрасте от 6 месяцев и старше и является приоритетной в системе здравоохранения Европы и США.
Вакцинация является безальтернативным способом защиты детей от тяжелых последствий гриппа в возрасте от 6 месяцев и старше и является приоритетной в системе здравоохранения Европы и США.

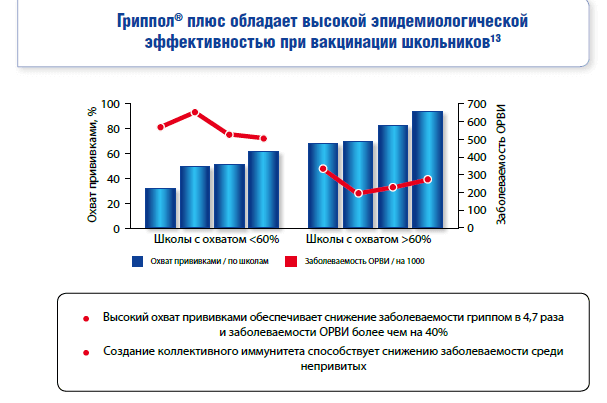
Защитный эффект после вакцинации против гриппа возникает в среднем через 2 недели после процедуры и сохраняется в течение года11.
Насколько безопасна вакцина Гриппол плюс у детей?

Существуют ли противопоказания к вакцинации?
Единственные условия, которые должны учитываться при планировании вакцинации, это
- отсутствие острого инфекционного заболевания
Вакцинация также противопоказана:
- при наличие у ребенка аллергии к белкам куриного яйца, так как при производстве противогриппозных вакцин используют куриные эмбрионы, и следы этих белков могут присутствовать в вакцине;
- при наличие у ребенка аллергии к белкам куриного яйца, так как при производстве противогриппозных вакцин используют куриные эмбрионы, и следы этих белков могут присутствовать в вакцине;
- осложнения после предыдущих вакцинаций;
- обострение имеющихся хронических заболеваний;
- другие состояния, сопровождающиеся повышением температуры.
Чтобы выявить эти ограничения, перед прививкой ребенка в обязательном порядке осматривает педиатр. Он же определяет показания к вакцинации.

Зачем моему ребенку вакцинация против гриппа?
Источник
Вакцина гриппозная тривалентная инактивированная полимер-субъединичная Гриппол®плюс
Регистрационное удостоверение: № ЛСР-006981/08
Торговое название: Гриппол® плюс
Группировочное название: Вакцина для профилактики гриппа [инактивированная] + Азоксимера бромид
Лекарственная форма: суспензия для внутримышечного и подкожного введения
Состав
В одной дозе (0,5 мл) содержится:
Активные компоненты:
Антиген вируса гриппа типа
A (N1H1)* с содержанием геммаглютинина – 5 мкг
Антиген вируса гриппа типа
A (N3N2)* с содержанием геммаглютинина – 5 мкг
Антиген вируса гриппа типа В*
с содержанием геммаглютинина – 5 мкг
Поликсидоний® (Азоксимера бромид) – 500 мкг
Вспомогательные компоненты:
Фосфатно-солевой буферный раствор – до 0,5 мл.
Не содержит консерванта.
* Штаммы антигенов вируса гриппа – в соответствии с рекомендациями ВОЗ на текущий эпидемический сезон.
Описание
Бесцветная или с желтоватым оттенком слегка опалесцирующая жидкость.
Характеристика препарата
Вакцина представляет собой протективные антигены (гемагглютинин и нейраминидаза), выделенные из очищенных вирусов гриппа типа А и В, выращенных на куриных эмбрионах, связанные с водорастворимым высокомолекулярным иммуноадъювантом N-оксидированным производным поли-1,4-этиленпиперазина (Полиоксидоний®, МНН: Азоксимера бромид). Антигенный состав вакцины изменяется каждый год в соответствии с эпидемической ситуацией и рекомендациями ВОЗ.
Фармакотерапевтическая группа:
МИБП-вакцина
Код АТХ
J07BB02
Иммунобиологические свойства
Вакцина вызывает формирование высокого уровня специфического иммунитета против гриппа. Защитный эффект после вакцинации, как правило, наступает через 8-12 дней и сохраняется до 12 месяцев, в том числе и у пожилых лиц. Защитные титры антител к вирусам гриппа после вакцинации лиц разного возраста определяются у 75-95 % вакцинированных.
Включение в вакцинный препарат иммуномодулятора Полиоксидоний®, обладающего широким спектром иммунофармакологического действия, обеспечивает увеличение иммуногенности и стабильности антигенов, позволяет повысить иммунологическую память, существенно снизить прививочную дозу антигенов, повысить устойчивость организма к другим инфекциям за счет коррекции иммунного статуса.
Показания к применению
Специфическая профилактика гриппа у детей, начиная с 6 месячного возраста, подростков и взрослых без ограничения возраста.
Контингенты, подлежащие прививкам. Вакцина особенно показана:
- Лицам с высоким риском возникновения осложнений в случае заболевания гриппом:
- старше 60 лет; детям дошкольного возраста, школьникам
- взрослым и детям, часто болеющим ОРЗ, страдающим хроническими соматическими заболеваниями, в том числе: болезнями и пороками развития центральной нервной, сердечно-сосудистой и бронхо-легочной систем, бронхиальной астмой, хроническими заболеваниями почек, сахарным диабетом, болезнями обмена веществ, аутоиммунными заболеваниями, аллергическими заболеваниями (кроме аллергии к куриным белкам); хронической анемией, врожденным или приобретенным иммунодефицитом, ВИЧ-инфицированным
- Лицам, по роду профессии имеющим высокий риск заболевания гриппом или заражения им других лиц:
- медработникам, работникам образовательных учреждений, сферы социального обслуживания, транспорта, торговли, полиции, военнослужащим и др.
Противопоказания к применению
- Аллергические реакции на куриный белок и компоненты вакцины
- Аллергические реакции на ранее вводимые гриппозные вакцины
- Острые лихорадочные состояния или обострение хронического заболевания. (Вакцинацию проводят после выздоровления или в период ремиссии)
- Нетяжёлые ОРВИ, острые кишечные заболевания (вакцинацию проводят после нормализации температуры).
Меры предосторожности
Не вводить внутривенно. В кабинетах, где проводится вакцинация, необходимо иметь средства противошоковой терапии. Вакцинированный должен находиться под наблюдением медработника в течение 30 мин после иммунизации.
Применение при беременности и на период грудного вскармливания
Доклинические исследования показали, что вакцина гриппозная инактивированная полимер-субъединичная не обладает эмбриотоксическим и тератогенным действием. Решение о вакцинации беременных должно приниматься врачом индивидуально с учетом риска заражения гриппом и возможных осложнений гриппозной инфекции. Наиболее безопасна вакцинация во втором и третьем триместрах.
Кормление грудью не является противопоказанием для вакцинации.
Способ применения и дозы
Вакцинация проводится ежегодно в осенне-зимний период. Возможна вакцинация в начале эпидемического подъема заболеваемости гриппом.
Детям старше 3-х лет, подросткам и взрослым вакцину вводят внутримышечно или глубоко подкожно в верхнюю треть наружной поверхности плеча (в дельтовидную мышцу), детям младшего возраста – в переднебоковую поверхность бедра внутримышечно.
Детям от 6 до 35 месяцев включительно по 0,25 мл двукратно с интервалом 3-4 недели.
Детям старше 36 месяцев и взрослым вакцину вводят однократно в дозе 0,5 мл.
Ранее не болевшим гриппом и невакцинированным детям возможно двукратное введение вакцины с интервалом 3-4 недели.
Пациентам с иммунодефицитом и получающим иммуносупрессивную терапиювозможно введение вакцины двукратно по 0,5 мл с интервалом 3-4 недели.
Перед применением вакцину следует выдержать до комнатной температуры и хорошо встряхнуть. Снять защитную крышку с иглы и удалить воздух из шприца, удерживая его в вертикальном положении иглой вверх и медленно нажимая на поршень.
Для иммунизации детей, которым показано введение 0,25 мл (1/2 дозы) вакцины, необходимо удалить половину содержимого шприца, надавив на поршень до специальной риски, отмеченной на корпусе шприца, или до метки красного цвета, нанесенной на край этикетки, и ввести оставшиеся 0,25 мл.
Вскрытие ампул и флаконов и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики: перед вскрытием ампульный нож, шейку ампулы, или пробку флакона протирают ватой, смоченной 70% этиловым спиртом, вскрывают ампулу, или прокалывают иглой резиновую пробку флакона, набирают вакцину в шприц одноразового применения и удаляют из шприца избыток воздуха. Спиртом протирают кожу в месте инъекции. Препарат во вскрытой ампуле, или флаконе хранению не подлежит.
Побочное действие
Вакцина является высокоочищенным препаратом, хорошо переносится детьми и взрослыми.
Частые (>1/100 <1/10). Местные реакции в виде болезненности, гиперемии, уплотнения и отёка в месте введения. Общие реакции: недомогание, слабость, субфебрильная температура
Нечастые (>1/1000 <1/100)Общие реакции в виде лёгкого насморка, боли в горле, головной боли и повышения температуры выше субфебрильной
Указанные реакции обычно проходят самостоятельно в течение 1-2 суток.
Редкие (>1/10000 <1/1000)Аллергические реакции, в том числе немедленного типа
Очень редкие (>1/10000)
- Со стороны нервной системы: невралгия, парестезия, неврологические расстройства;
- со стороны опорно-двигательного аппарата: миалгия
Пациент должен быть проинформирован о необходимости сообщить врачу о любых выраженных, или не указанных в данной инструкции побочных реакциях
Передозировка
Случаи передозировки не зафиксированы
Взаимодействие с другими лекарственными средствами
Вакцина Гриппол® плюс может применяться одновременно с инактивированными и живыми вакцинами Национального календаря профилактических прививок (за исключением БЦЖ и БЦЖ-М) и инактивированными вакцинами календаря профилактических прививок по эпидемическим показаниям (за исключением антирабических). При этом должны учитываться противопоказания к каждой из применяемой вакцин; препараты следует вводить в разные участки тела разными шприцами.
Вакцина может вводиться на фоне базисной терапии основного заболевания. Вакцинация пациентов, получающих иммуносупрессивную терапию (кортикостероиды, цитотоксические препараты, радиотерапия), может быть менее эффективной.
Особые условия
В день прививки вакцинируемые должны быть осмотрены врачом (фельдшером) с обязательной термометрией. При температуре выше 37,0 °С вакцинацию не проводят.
Не пригоден к применению препарат в ампулах, флаконах, шприц-дозах с нарушенной целостностью или маркировкой, при изменении физических свойств (цвета, прозрачности), при истекшем сроке годности, нарушении требований к условиям хранения.
Вакцину запрещается вводить внутривенно
Влияние на способность к вождению автомобиля, или управление машинами и механизмами
Гриппол® не влияет на способность к вождению автомобиля, или управление машинами и механизмами.
Форма выпуска
Суспезния для внутримышечного и подкожного введения
По 0,5 мл (1 доза) в шприцы одноразового применения или в ампулы или флаконы, герметично укупоренные резиновыми пробками и обжатые алюминиевыми колпачками.
По 1, 5 или 10 шприцев в контурной ячейковой упаковке из пленки поливинилхлоридной, покрытой фольгой алюминиевой с полимерным покрытием, или бумагой ламинированной с полимерным покрытием. По 1 (содержащей 1 или 5 или 10 шприцев) или 2 (содержащих 5 шприцев) контурные упаковки в пачку из картона вместе с инструкцией по применению.
По 5 ампул или флаконов в контурной ячейковой упаковке из пленки поливинилхлоридной. По 1 или 2 контурных ячейковых упаковок в пачку из картона вместе с инструкцией по применению.
Или 5 или 10 ампул или флаконов без контурной ячейковой упаковки помещают в пачку из картона вместе с инструкцией по применению.
Условия хранения
Хранить в защищенном от света месте при температуре от 2 °С до 8 °С.
Беречь от детей!
Не замораживать! Препарат, подвергшийся замораживанию, применению не подлежит.
Условия транспортировки
Транспортирование всеми видами крытого транспорта в светонепроницаемых контейнерах при температуре от 2 °С до 8 °С, в условиях, исключающих замораживание. Допускается транспортирование при температуре до 25 ° С в течение 6 часов.
Срок годности
1 год. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска
По рецепту.
Юридическое лицо, на которого выдано регистрационное удостоверение
Владелец регистрационного удостоверения и производитель:
ООО «НПО Петровакс Фарм»
Юридический адрес и адрес производства: Российская Федерация, 142143, Московская область, Подольский район, с. Покров, ул. Сосновая, д.1, тел./факс: (495) 926-21-07, : @petrovax.ru
Рекламации на качество препарата по физическим свойствам, фасовке, упаковке и информацию о случаях повышенной реактогенности или развития поствакцинальных осложнений с обязательным указанием номера серии и даты изготовления с последующим представлением медицинской документации направлять в адрес предприятия-производителя ООО «НПО Петровакс Фарм» и в Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор)
Источник
Грипп остается одним из самых распространенных инфекционных вирусных заболеваний. Короткий инкубационный период, урбанизация населения, развитие современных средств скоростного транспорта, тесные международные контакты, массовые миграции являются основными факторами, обусловливающими стремительный подъем заболеваемости и приводящими к резкому увеличению осложнений, особенно у лиц с хроническими заболеваниями. По данным Всемирной Организации Здравоохранения, при ежегодных эпидемиях гриппа заболевает 20-30% детей [1]. В сезон 2007-2008 гг. удельный вес детей 3-6 лет среди заболевших гриппом составил 43,5%, тогда как школьников только 14%, взрослых – 2,8% [2]. В 2008 г. заболеваемость гриппом детей составила 465,1 на 100 тыс. детей, что на 47,9% ниже по сравнению с предыдущим годом [3].
Всемирная Организация Здравоохранения рассматривает вакцинацию, как единственную социально и экономически оправданную меру борьбы с гриппом [4]. Более того, ежегодная иммунизация – это не только профилактика сезонного гриппа, но и предупреждение развития возможной пандемии [5,6]. Накопленный опыт эффективности вакцинации против гриппа весьма убедителен; экспертами ВОЗ сформулированы рекомендации по увеличению охвата прививками до 60% населения к 2010 г. и до 95% к 2016 г. Вакцинация детей от гриппа уже много лет входит в Национальные календари США и большинства европейских стран. С 2006 г. в России в рамках Национального календаря осуществляется бесплатная вакцинация против гриппа детей, посещающих дошкольные учреждения, учащихся 1-11 классов [1].
Предстоящий эпидсезон будет отличаться циркуляцией не только обычных сезонных штаммов вируса, но и распространением «свиного» гриппа A/H1N1/Калифорния/04/2009. Проведенные исследования перекрестной реактивности показали, что иммунизация против сезонных штаммов способна в ряде случаев повысить титр антител к пандемическому штамму [7]. Отдельно следует подчеркнуть, что вакцинация позволит снизить циркуляцию сезонных вирусов среди людей, ограничивая возможность реассортации и появление новых потенциально опасных форм вируса. В сложившейся ситуации специалисты особенно подчеркивают необходимость проведения массовой вакцинации против сезонного гриппа [8].
В практике здравоохранения применяются живые, инактивированные расщепленные и субъединичные вакцины. Последние наиболее безопасны по сравнению с цельновирионными инактивированными и живыми и именно поэтому предпочтительны для вакцинации детских контингентов. Однако иммуногенность субъединичных вакцин не всегда бывает высокой и в значительной степени зависит от качества сборки субъединиц после удаления детергента. Одним из способов увеличения иммуногенности является использование адъювантов с иммуномодулирующим действием или непосредственно иммуномодуляторов в качестве адъюванта. К таким препаратам относится полиоксидоний, стимулирующий антигенпрезентирующие клетки и лимфоциты [9]. В вакцинах семейства Гриппол (Гриппол, Гриппол плюс, Гриппол Нео) сочетается современная технология получения и сборки протективных антигенов гриппа с иммуноадъювантом – Полиоксидонием.
Вакцина Гриппол плюс содержит в своем составе по 5 мкг высокоочищенных антигенов вируса гриппа и 500 мкг Полиоксидония в качестве адъюванта. Вакцина производится на современном предприятии в соответствии с мировыми стандартами производства (GMP). Выпускается в современной упаковке – индивидуальная шприц-доза со специальной атравматичной иглой для безболезненной вакцинации. Важно, что впервые в составе инактивированной отечественной вакцины нет консерванта (тиомерсала).
Повышение современных требований к оценке безопасности вакцин и необходимость ежегодной иммунизации против гриппа в первую очередь детей с увеличением охвата вакцинируемых детских контингентов определили цель настоящего исследования – оценить реактогенность и переносимость вакцины гриппозной тривалентной инактивированной полимер-субъединичной Гриппол плюс у детей в возрасте от 3 до 17 лет.
Пациенты и методы
На базе отдела профилактики инфекционных заболеваний ФГУ НИИ детских инфекций в осенний период проведена вакцинация 153 детей: 37 в возрасте 3-6 лет (20 мальчиков и 17 девочек); 64 в возрасте 7-12 лет (29 мальчиков, 35 девочек); 52 в возрасте 13-17 лет (24 мальчика, 28 девочек).
Критерии включения в исследование:
1. Лица обоего пола в возрасте от 3 до 17 лет.
2. Предыдущая вакцинация против гриппа не менее, чем за 6 мес. до настоящего исследования.
3. Отсутствие противопоказаний, предусмотренных инструкцией по применению.
Критерии исключения:
1. Наличие в анамнезе аллергических реакций на белковые препараты (в том числе сенсибилизации к белку куриного яйца).
2. Текущие острые инфекционные и неинфекционные заболевания, включая период реконвалесценции, менее одного месяца с момента клинического выздоровления.
3. Перенесенный гепатит или менингококковая инфекция, менее чем через 6 мес после выздоровления.
4. Системные заболевания соединительной ткани.
5. Наличие декомпенсированных заболеваний, которые могут повлиять на проведение исследования (декомпенсированная патология сердечно-сосудистой системы, больные с острой почечной или печеночной недостаточностью, онкологические заболевания, ВИЧ и ВИЧ-ассоциированные заболевания).
Все родители (опекуны) детей подписали добровольное информированное согласие на вакцинацию и участие в исследовании. Вакцинация проводилась внутримышечно в дельтовидную мышцу в объеме 0,5 мл. Клиническое наблюдение перед прививкой, в течение первых 5 суток, на 21-е сутки после прививки включало врачебный осмотр, термометрию, измерение артериального давления (АД). Течение поствакцинального периода оценивали как гладкое (отсутствие интеркуррентных заболеваний) или осложненное (присоединение интеркуррентных заболеваний после иммунизации). Следует отметить, что в поствакцинальном периоде проводился мониторинг и регистрация любых событий (как общих, так и местных), которые могут быть связаны или не связаны с вакцинацией. При гладком течении общие вакцинальные реакции, развивающиеся в первые 3 дня после прививки, разделяли по общепринятым критериям на слабые (появление субфебрильной температуры до 37,5°С при отсутствии симптомов интоксикации), средней силы (подъем температуры от 37,6°С до 38,5°С, кратковременные симптомы интоксикации в виде недомогания, головной боли, нарушения сна, аппетита), сильные (лихорадка выше 38,6°С, выраженные проявления интоксикации). При отсутствии температуры и симптомов интоксикации нормальный вакцинальный процесс считали бессимптомным.
На каждого привитого заведена «Индивидуальная регистрационная карта» для регистрации общих и местных реакций, возникших после вакцинации. Местные вакцинальные реакции определяли в первые 4-5 сут. и расценивали как: нормальные слабые (отек и гиперемия в месте введения вакцины не превышали 25 мм в диаметре), средние (диаметр 25-50 мм) и сильные (диаметр более 50 мм). В качестве местной вакцинальной реакции регистрировали также болезненность по субъективным ощущениям как слабую, среднюю и выраженную. В течение 4 мес. после вакцинации проведен учет интеркуррентной заболеваемости на основании опроса и справок о перенесенных заболеваниях, выданных поликлиникой по месту жительства детей.
К нормальным местным реакциям, сопровождающим вакцинацию, относились покраснение, уплотнение, отек, болезненность, крапивница, увеличение близлежащих от места инъекции лимфоузлов. Эти симптомы развиваются сразу после введения препарата и проходят в течение нескольких дней (в первые 4 дня) [10].
Статистический анализ результатов исследования проводился с помощью программы ISTICA 6.0 (Soft, США). Количественные показатели представлены в виде среднего арифметического значения ± стандартная ошибка среднего. Статистический анализ проведен с использованием t-критерия Стьюдента, а при отсутствии нормального распределения – с помощью критерия Манна-Уитни. Различия считали статистически значимыми при р<0,05.
Результаты исследования
и их обсуждение
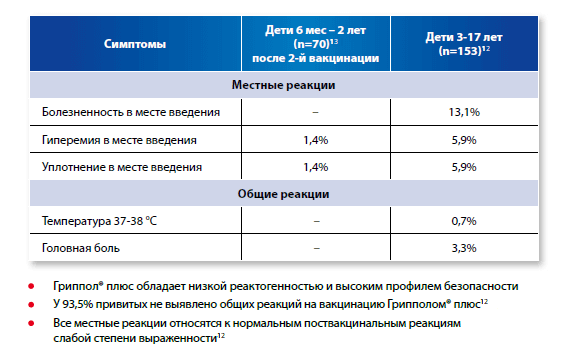
Анализ клинических проявлений местного вакцинального процесса показал, что у 13,1% привитых небольшая болезненность в месте введения вакцины отмечалась непосредственно после инъекции и сохранялась у 11,1% на 2-й день, у 7,2% на 3-й день (табл. 1). Следует отметить возможный субъективный характер этой жалобы, так как на болезненность жаловались только дети старшего возраста (7-17 лет). Объективные же проявления местной реакции в первые двое суток в виде небольшой гиперемии и уплотнения при отсутствии жалоб на болезненность чаще диагностировали у детей 3-6 лет. Гиперемия и уплотнение, которые расцениваются, как отражение нормальной реакции организма на введение белка либо на инъекцию, отмечены у 9 человек в день вакцинации. К 4 сут. проявления гиперемии сохранились только у 1 ребенка, уплотнения сохранялись не более 2 дней. Размеры гиперемии и уплотнения в основном не превышали 3-6 мм, у 3 детей размер гиперемии составил соответственно 10, 20 и 30 мм, у одного ребенка зарегистрировано уплотнение, не превышающее 15 мм.
Таким образом, все наблюдаемые явления в месте инъекции относились к нормальным реакциям слабой степени выраженности, не вызывали дискомфорта у детей и исчезали самостоятельно в течение 2-4 дней.
Оценка общего вакцинального процесса свидетельствует, что 99,3% детей переносили вакцинацию без температуры (табл. 2). У 1 ребенка из старшей группы в течение всех 5 дней наблюдения отмечалась температура 37,0°С без каких-либо жалоб и других клинических проявлений, что можно расценивать как фоновую температуру. У второго подростка на 3-й день отмечено однократное увеличение температуры до 37,2°С, также без жалоб, что расценено как обычная слабая вакцинальная реакция. У 1 ребенка в группе 7-12 лет однократный подъем температуры до 38,4°С на 4-й день сопровождался жалобами на боли в горле, что рассматривали как легкое респираторное заболевание, развившееся в поствакцинальном периоде и продолжавшееся 2-3 дня. Таким образом, только у 1 (0,65%) из 153 детей в поствакцинальном периоде была зарегистрирована слабой силы нормальная реакция с субфебрильной температурой.
Детальная оценка общего состояния детей после вакцинации свидетельствует о хорошей переносимости вакцины Гриппол плюс. У 93,5% привитых не выявлено проявлений вакцинального процесса, вакцинация протекала бессимптомно. Ни у одного ребенка не было поствакцинальных осложнений. Жалобы на головную боль и недомогание отмечались только у детей школьного возраста в 2,6-6,3% случаев, что не позволяет исключить их связь с другими факторами (учебной и физической нагрузкой, наслоившимися интеркуррентными заболеваниями) (табл. 2). У одной девочки 12 лет с вегето-сосудистой дистонией в анамнезе отмечались жалобы на головокружения, у нее же были жалобы и на болезненность в месте введения вакцины в течение трех дней при отсутствии объективных проявлений местного (гиперемия и уплотнение) и общего (температура) вакцинального процесса. Если учитывать любые жалобы, появившиеся в первые дни после вакцинации (недомогание, головная боль, нарушение сна, боли в животе, и т.д.), а также субфебрильную температуру, то они отмечались у 10 из 153 детей (6,5%), причем все это были дети старше 6 лет. Из 10 детей с какими-либо жалобами (у всех отмечалось несколько жалоб одновременно), у 5 постепенно развились катаральные явления в виде ринита, у троих – со второго дня присоединился кашель. С 4-го дня выявлено еще 5 детей с ринитом, из которых 4 – с кашлем, у 1 из них отмечены жалобы на тошноту и боли в животе, что заставило подозревать развитие энтеровирусной инфекции. Учитывая увеличение числа детей с клиническими признаками ОРВИ на поздних сроках (4-5 день после прививки), можно предполагать, что все 10 детей, имевших ринит, были инфицированы ОРВИ и, следовательно, симптоматика недомоганий и других указанных выше жалоб была связана с заболеванием, а не с прививкой. Все дети с катаральными симптомами были школьного возраста, что также говорит в пользу заболевания, а не вакцинальной реакции. С учетом сроков появления (катаральный синдром выявлен после 4 сут.) только у 5 детей указанные симптомы расценены, как интеркуррентные заболевания.
При анализе безопасности вакцины отмечалось, что Гриппол плюс хорошо переносится детьми, реакции зарегистрированы у небольшого числа детей и относятся к нормальным вакцинальным реакциям слабой степени выраженности. Полученные результаты позволяют утверждать, что вакцина Гриппол плюс – малореактогенный препарат, который имеет высокий профиль безопасности. Комплекс свойств препарата (сниженная антигенная нагрузка на организм, иммуноадъювантные свойства Полиоксидония, отсутствие консерванта, доказанная в ходе двойных слепых испытаний высокая иммуногенность) позволяет рекомендовать его для широкого применения в детской практике, в том числе в рамках Национального календаря прививок.
Литература
1. Таточенко В.К. и др. Иммунопрофилактика-2009 *(Справочник), М., 2009, с.66
2. Об итогах распространения гриппа и ОРВИ в России в эпидсезон 2007/2008гг. Письмо Роспотребнадзора РФ от 19.06.08 №01/6424-8-32
3. О санитарно-эпидемиологической обстановке в Российской Федерации в 2008 году: Государственный доклад.-М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009.-467 с.
4. www.who.int/wer No. 33, 2005, 80, 277-288
5. CDC. Prevention and control of influenza: ations of the Advisory Committee on Immunization Practices [ACIP]. MMWR 2005; 54 [No. RR-8]:1-42.
6. Fiore A.E., Shay D.K., Broder K., et al. Prevention and Control of Influenza ations of the Advisory Committee on Immunization Practices (ACIP), 2008. MMWR, August 8, 2008 . – 57.-RR07. – Р.1-60
7. Department of Health and Human Services Centers for Disease Control and Prevention. Serum Cross-Reactive Antibody Response to a Novel Influenza A (H1N1) Virus After Vaccination with Seasonal Influenza Vaccine. Morbidity and Mortality Weekly Report, 2009 58(19)
8. Centers for Disease Control and Prevention. 2009-10 Influenza Prevention & Control Reccomendations (https://www.cdc.gov/flu/professionals/acip/persons.htm)
9. Пинегин Б.В., Иванова А.С., Климова С.В. и др. Влияние тривалентной конъюгированной полимер-субъединичной вакцины Гриппол на иммунный статус привитых добровольцев // Иммунология. 2003. №3. С. 8-15.
10. Харит С.М., Лакоткина Е.А., Черняева Т.В., и др. Дифференциальный диагноз поствакцинальных осложнений // Т-пациент. Прил. Педиатрия. 2006, №2. С. 17-22
Источник
