Прививка и генная инженерия

Генная инженерия — новаторские технологии, создающие принципиально новые, ранее в природе не встречавшиеся сочетания генов. Другими словами — это инструмент для изменения кода наследственности. Если внести в организм новые гены (частички ДНК), то он может приобрести уникальное желательное свойство, которым до этого не обладал.
«Построение» генно-инженерных вакцин — одно из перспективных направлений данной области биотехнологий. Более 60% фармацевтических фирм занято разработкой новых лекарственных форм.
Методика создания генно-инженерных вакцин
Воспроизводство генно инженерных вакцин (ГИВ) начинается с синтеза желаемого белкового соединения, для этого требуется пройти следующие этапы:

- из ДНК вируса «вырезают» нужный фрагмент – ген. В каждом отдельном гене содержится информация по производству какого-либо белка в клетке. «Разрезание» происходит с помощью особых ферментов (рестриктаз);
- затем «выщепленный» вирусный ген соединяют с так называемым вектором (это ДНК, чаще бактериальная плазмида), обеспечивающим внедрение в клетку;
- полученную ДНК-конструкцию вводят в бактериальную клетку;
- далее происходит размножение (репликация) нужного гена, то есть идёт экспрессия «вшитого» генома вируса – преобразование наследственной информации в белок.
В результате бактериальные клетки, выращиваемые в питательной среде, начинают вырабатывать белки-возбудители инфекции, то есть синтезировать вещество, ранее им несвойственное. Белки впоследствии выделяют, очищают – материал для вакцины готов.
При получении ГИВ в качестве векторов (помимо искусственно созданных плазмид) выступают дрожжи, фаги, вирусы животных, например, аденовирусы или вирус осповакцины.
Преимущества и недостатки
Среди достоинств генно-инженерных вакцин следует отметить:

- низкую реактогенность, а, следовательно, и минимум побочных реакций, поскольку в составе таких препаратов нет живых организмов;
- формирование узкоспецифического иммунного отклика;
- возможное комбинирование по иммуногенным характеристикам.
Среди «минусов» – недостаточная эффективность, поскольку вирусы очень вариабельны.
Особенности применения
Методика получения противовирусных вакцин посредством генной инженерии была освоена в 70-е годы 20-го века.
Необходимость разработках была вызвана:
- нехваткой источников сырья (животных);
- невозможностью размножать вирусные клетки на классических объектах;
- необходимостью минимизировать реактогенность полученного гибридного вируса (в случае с живыми поливакцинами).
Преодолеть эти трудности удалось в 1992 году, когда был разработан новейший метод в профилактике вирусных инфекций: изобретена ДНК вакцина. Самым типичным примером необходимости создания ГИВ является гепатит В.
Здесь сложность заключается в том, что учёным пока не удаётся найти культуры клеток, чувствительных к этому вирусу. В данном случае вирусный геном размножают в клетках Е. coli с применением плазмидных векторов. Бактерии, содержащие рекомбинантные плазмиды, вырабатывают белки (антигены), формирующие в организме сбалансированный полноценный иммунитет.
Сейчас активно разрабатываются ГИВ против гриппа, ящура и клещевого энцефалита. Прогрессивным направлением является создание многокомпонентных препаратов, состоящих из двух и более плазмидных форм. Но использование ДНК вакцин пока изучено только на животных.
 Не до конца выяснена онкогенная опасность препарата, неизвестно время, в течение которого организм успеет выработать антигенный белок. Его длительное образование может вызвать у прививаемого различного рода патологии.
Не до конца выяснена онкогенная опасность препарата, неизвестно время, в течение которого организм успеет выработать антигенный белок. Его длительное образование может вызвать у прививаемого различного рода патологии.
Поэтому нужно время, чтобы ДНК вакцины стали применяться для человека. Преимуществом данных препаратов является довольно простой техпроцесс изготовления, удобство хранения и дешевизна производства.
К тому же их введение в организм имитирует нахождение в нём реального патогена, поскольку синтез белковых молекул, являющихся антигенами по сути, осуществляется напрямую в клетках человека. Поэтому последующие модификации белков полностью соответствуют тому, как это бы происходило при настоящей инфекции.
Примеры генно-инженерных вакцин
Когда частичка гена какого-либо возбудителя, ответственного за «производство» вирусного белка, встраивается в геном другого вируса (вектор), получается рекомбинантная вакцина.
Пример рекомбинантного препарата – вакцина против гепатита В, среди них:
- бельгийский Энджерикс;
- кубинская дрожжевая рекомбинантная вакцина;
- отечественный препарат (Комбиотех);
- американская ДНК-рекомбинантная вакцина.
Пример ГИВ – живые поливалентные вакцины (бельгийский Варилрикс). Кроме того, к генно-инженерным относится прививка от сифилиса и холеры, гриппа и бруцеллёза, бешенства.
В будущем предполагается использование векторов, в которые вшиты не только гены, отвечающие за синтез протективных белков, но и гены, контролирующие различные медиаторы (информационные молекулы) иммунного отклика.
Уже получены гибридные штаммы БЦЖ, доказавшие свою эффективность в отношении рака мочевого пузыря, а также туберкулёза. И хотя синтез бактерий (в отличие от вирусов) затруднителен, это лишь вопрос времени.
Видео по теме
Доктор Комаровский о распространенных мифах о вакцинации:
Генная инженерия даёт возможность создавать с помощью микроорганизмов массу полезных соединений: красители, аминокислоты, витамины и ферменты. Открываются и потенциальные перспективы разработки инновационных лекарств – генно-модифицированных субъединичных вакцин. Их главный «плюс» – высокая иммуногенность и отсутствие балластных белков.
Источник
Оглавление темы “Иммунодефициты. Вакцины. Сыворотки. Иммуноглобулины.”:
1. Клеточные иммунодефициты. Т-клеточная недостаточность иммунитета. Диагностика клеточных иммунодефицитов. Синдром Ди Джорджи. Синдром Незелофа. Тяжёлый комбинированный иммунодефицит. Синдром Вискотта-Олдрича.
2. Транзиторные иммунодефициты. Механизм развития транзиторных иммунодефицитов. Иммунотерапия. Иммунопрофилактика. Иммунобиологические препараты.
3. Виды иммунобиологических препаратов. Эффекты иммунобиологических препаратов.
4. Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
5. Инактивированные вакцины. Корпускулярные ( цельновирионные ) вакцины. Компонентные ( субъединичные ) вакцины.
6. Генно-инженерные ( рекомбинантные ) вакцины. Векторные вакцины. Синтетические вакцины.
7. Молекулярные вакцины. Анатоксины. Классификация анатоксинов. Конъюгированные вакцины.
8. Моновалентные вакцины. Ассоциированные ( поливалентные ) вакцины. Методы вакцинопрофилактики. Методы введения вакцин. Типы вакцинаций. Виды вакцинаций.
9. Эффективность вакцин. Проверка эффективности вакцин. Индекс защиты вакцины. Индекс эффективности вакцины.
10. Сывороточные иммунные препараты. Иммунные сыворотки. Гетерологичные сыворотки. Гомологичные сыворотки. Иммунные иммуноглобулины.
Генно-инженерные ( рекомбинантные ) вакцины. Векторные вакцины. Синтетические вакцины.
Генно-инженерные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета (более подробно см. главу 7). Возможны несколько вариантов создания генно-инженерных вакцин.
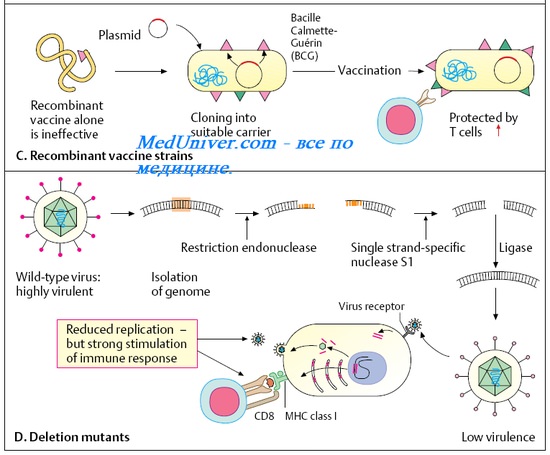
• Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы.
• Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением Аг и его использованием в качестве иммуногена.
• Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин.
Ряд современных противовирусных вакцин сконструирован путём введения генов, кодируюших основные Аг патогенных вирусов и бактерий в геном вируса осповакцины (HBsAg вируса гепатита В) и непатогенных для человека сальмонелл (HBsAg вируса гепатита В и Аг токсина столбнячной палочки). Другим примером служит введение генов возбудителя туберкулёза в вакцинный штамм БЦЖ, что придаёт ему большую активность в качестве дивергентной вакцины. Такие препараты известны как векторные вакцины.
Для активной иммунопрофилактики гепатита В также предложена вакцина, представляющая собой HBsAg вируса. Его получают из дрожжевых клеток, в которые введён вирусный ген (в форме плазмиды), кодирующий синтез HBsAg. Препарат очищают от дрожжевых белков и используют для иммунизации. В качестве метода более быстрой и дешёвой наработки бактериальных экзотоксинов в настоящее время разработаны методы их получения при помощи неприхотливых микроорганизмов, в геном которых искусственно внесены гены токсинообразования (например, в виде плазмид).
Селективное удаление генов вирулентности открывает широкие перспективы для получения стойко аттенуированных штаммов шигелл, токсигенных кишечных палочек, возбудителей брюшного тифа, холеры и других диареегенных бактерий. Возникает возможность создания поливалентных вакцин для профилактики кишечных инфекций, вводимых внутрь. Другим важным . направлением выступает возможность получения аттенуированных штаммов возбудителя туберкулёза человека и их использования в качестве вакцин.
Синтетические вакцины
Принцип конструирования вакцин включает синтез или выделение нуклеиновых кислот или полипептидных последовательностей, образующих Aг-детерминанты, распознаваемых нейтрализующими AT. Непременные компоненты таких вакцин — сам Аг, высокомолекулярный носитель (винилпирролидон или декстран) и адъювант (повышающий иммуногенность вакцин). Подобные препараты наиболее безопасны в плане возможных поствакцинальных осложнений, но их разработке мешают две проблемы. Во-первых, не всегда имеется информация об идентичности синтетических эпитопов естественным Аг. Во-вторых, низкомолекулярные синтетические пептиды обладают низкой иммуногенностью, что приводит к необходимости подбора соответствующих адъювантов.
С другой стороны, введение синтетических вакцин в комбинации с адъювантами и иммуномодуляторами перспективно у лиц с нарушениями иммунного статуса. Особые перспективы имеет использование нуклеиновых кислот для иммунопрофилактики инфекций, вызываемых внутриклеточными паразитами. В эксперименте показано, что иммунизация организма РНК и ДНК многих вирусов, малярийного плазмодия или возбудителя туберкулёза приводит к развитию стойкой невосприимчивости к заражению.
– Также рекомендуем “Молекулярные вакцины. Анатоксины. Классификация анатоксинов. Конъюгированные вакцины.”
Источник
Вакцинация способствует формированию у реципиента иммунитета к патогенным микроорганизмам и тем самым защищает его от инфекции. В ответ на пероральное или парентеральное введение вакцины в организме хозяина вырабатываются антитела к патогенному микроорганизму, которые при последующей инфекции приводят к его инактивации (нейтрализации или гибели), блокируют его пролиферацию и не позволяют развиться заболеванию.
Эффект вакцинации открыл более 200 лет назад – в 1796 г. – врач Эдуард Дженнер. Он доказал экспериментально, что человек, перенесший коровью оспу, не очень тяжелую болезнь крупного рогатого скота, становится невосприимчивым к оспе натуральной. Натуральная оспа – высококонтагиозное заболевание с высокой смертностью; даже если больной не погибает, у него нередко возникают различные уродства, психические расстройства и слепота. Дженнер публично провел прививку коровьей оспы 8-летнему мальчику Джеймсу Фиппсу, использовав дая этого экссудат из пустулы больной коровьей оспой, а затем через определенное время дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограничились покраснением в месте прививки, исчезнувшим через несколько дней. Вакцины такого типа получили название дженеровских. Однако такой путь вакцинации не получил большого развития. Это объясняется тем, что в природе не всегда возможно найти малопатогенный аналог болезнетворного микроорганизма, пригодный для приготовления вакцины.
Более перспективным оказался метод вакцинации предложенный Пастером. Пастеровские вакцины получают на основе убитых (инактивированных) патогенных микроорганизмов либо живых, но не вирулентных (аттенуированных) штаммов. Для этого штамм дикого типа выращивают в культуре, очищают, а затем инактивируют (убивают) или ослабляют (аттенуируют) таким образом, чтобы он вызывал иммунный ответ, достаточно эффективный в отношении нормального вирулентного штамма.
Для иммунопрофилактики некоторых болезней, таких, например, как столбняк или дифтерия, наличие самих бактерий в вакцине необязательно. Дело в том, что главной причиной этих заболеваний являются выделяемые этими бактериями патогенные токсины. Ученые обнаружили, что эти токсины инактивируются формалином и могут затем безопасно использоваться в вакцинах. При встрече иммунной системы с вакциной, содержащей безопасный анатоксин, она вырабатывает антитела для борьбы с настоящим токсином. Такие вакцины получили название анатоксины.
Ранее такие инфекционные болезни, как туберкулез, оспа, холера, брюшной тиф, бубонная чума и полиомиелит, были настоящим бичом для человечества. С появлением вакцин, антибиотиков и внедрением мер профилактики эти эпидемические болезни удалось взять под контроль. К сожалению, против многих болезней человека и животных вакцин до сих пор не существует или они малоэффективны. Сегодня во всем мире более 2 млрд. людей страдают заболеваниями, которые можно было бы предотвратить с помощью вакцинации. Вакцины могут оказаться полезными и для профилактики постоянно появляющихся «новых» болезней (например, СПИДа).
Несмотря на значительные успехи в создании вакцин против таких заболеваний, как краснуха, дифтерия, коклюш, столбняк и полиомиелит, производство и использование классических ”пастеровских” вакцин сталкивается с целым рядом ограничений.
1. Не все патогенные микроорганизмы удается культивировать, поэтому для многих заболеваний вакцины не созданы.
2. Для получения вирусов животных и человека необходима дорого-стоящая культура животных клеток.
3. Титр вирусов животных и человека в культуре и скорость их размноже-ния часто бывают очень низкими, что удорожает производство вакцин.
4. Необходимо строго соблюдать меры предосторожности при производстве вакцин из высокопатогенных микроорганизмов, чтобы не допустить инфицирования персонала.
5. При нарушении производственного процесса в некоторые партии вакцины могут попасть живые или недостаточно ослабленные вирулентные микроорганизмы, что может привести к неумышленному распространению инфекции.
6. Аттенуированные штаммы могут ревертировать (восстанавливать свою вирулентность), поэтому необходимо постоянно контролировать их вирулентность.
7. Некоторые заболевания (например, СПИД) нельзя предупреждать с помощью традиционных вакцин.
8. Большинство современных вакцин имеют ограниченный срок годности и сохраняют активность только при пониженной температуре, что затрудняет их использование в развивающихся странах.
В последнее десятилетие, с развитием технологии рекомбинантных ДНК, появилась возможность создать новое поколение вакцин, не обладающих недостатками традиционных вакцин. Основные подходы к созданию вакцин нового типа на основе методов генной инженерии заключаются в следующем:
1. Модификация генома патогенного микроорганизма. Работы в этой области ведутся по двум основным направлениям:
А) Патогенный микроорганизм модифицируют, делетируя (удаляя) из его генома гены, ответственные за вирулентность (гены кодирующие синтез бактериальных токсинов). Способность вызывать иммунный ответ при этом сохраняется. Такой микроорганизм можно безбоязненно использовать в качестве живой вакцины, поскольку выращивание в чистой культуре исключает возможность спонтанного восстановления удаленного гена.
Примером такого подхода является разработанная недавно противохолерная вакцина на основе рекомбинантного штамма V.cholerae,у которого была удалена нуклеотидная последовательность, кодирующая синтез энтеротоксина, ответственного за патогенный эффект. Проводимые в настоящее время клинические испытания эффективности этой формы как противохолерной вакцины пока не дали однозначного результата. Вакцина обеспечивает почти 90%-ную защиту от холеры, но у некоторых испытуемых наблюдаются побочные эффекты, поэтому она нуждается в дальнейшей доработке.
Б) Другой способ получения непатогенных штаммов, пригодных для создания на их основе живых вакцин, состоит в удалении из генома патогенных бактерий хромосомных областей, отвечающих за некоторые независимые жизненно важные функции (метаболитические процессы), например синтез определенных азотистых оснований или витаминов. При этом лучше делетировать по крайней мере две такие области, поскольку вероятность их одновременного восстановления очень мала. Предполагается, что штамм с двойной делецией будет обладать ограниченной пролиферативной способностью (ограниченным сроком жизни в иммунизируемом организме) и сниженной патогенностью, но обеспечит выработку иммунного ответа. На подобном подходе в настоящее время созданы и проходят клинические испытания вакцины против сальмонеллеза и лейшманиоза.
2. Использование непатогенных микроорганизмов с встроенными в клеточную стенку специфическими имуногенными белками. С помощью методов генной инженерии создают живые непатогенные системы переноса отдельных антигенных участков (эпитопов) или целых имуногенных белков неродственного патогенного организма. Один из подходов, используемых при создании таких вакцин, состоит в размещении белка – антигена патогенной бактерии на поверхности живой непатогенной бактерии, так как в этом случае он обладает более высокой иммуногенностью, чем когда он локализован в цитоплазме. Многие бактерии имеют жгутики, состоящие из белка флагеллина; под микроскопом они выглядят как нити, отходящие от бактериальной клетки. Если сделать так, что жгутики непатогенного микроорганизма будут нести специфический эпитоп (белковую молекулу) патогенного микроорганизма, то можно будет индуцировать выработку защитных антител. Вакцина созданная на основе таких рекомбинантных непатогенных микроорганизмов будет способствовать развитию выраженного иммунного ответа на патогенный микроорганизм.
Именно такой подход использовали при создании противохолерной и противостолбнячной вакцины.
3. Создание субъединичных (пептидных) вакцин.Если какие то патогенные микроорганизмы не растут в культуре, то на их основе не возможно создать классическую пастеровскую вакцину. Однако, можно выделить, клонировать и экспрессировать в альтернативном непатогенном хозяине (например, в Е. coliили линии клеток млекопитающих) гены, отвечающие за выработку тех или иных антигенных белков, а затем выделить и использовать эти белки после очистки как «субъединичные» вакцины.
Субъединичные вакцины имеют свои достоинства и недостатки. Достоинства состоят в том, что препарат, содержащий только очищенный иммуногенный белок, стабилен и безопасен, его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могли бы вызывать нежелательные побочные эффекты в организме-хозяине. Недостатки заключаются в том, что очистка специфического белка стоит дорого, а конформация выделенного белка может отличаться от той, которую он имеет in situ (т.е. в составе вирусного капсида или оболочки), что может приводить к изменению его антигенных свойств. Решение о производстве субъединичной вакцины принимается с учетом всех имеющих отношение к делу биологических и экономических факторов. В настоящее время в разных стадиях разработки и клинических испытаний находятся вакцины против герпеса, ящура и туберкулеза.
4. Создание “векторных вакцин”. Эти вакцины принципиально отличаются от вакцин других типов тем, что имуногенные белки не вводятся в готовом виде в имунизируемый организм с компонентами вакцины (клетки микроорганизмов и продукты их разрушения), а синтезируются в непосредственно в нем, за счет экспрессии кодирующих их генов, которые в свою очередь переносятся в имунизируемый организм с помощью специальных векторов. Наиболее широко “векторные вакцины” создаются на основе вируса коровьей оспы (ВКО), а так же ряда других условно- или малопатогенных вирусов (аденовирус, полиовирус, вирус ветряной оспы). ВКО достаточно хорошо изучен, его геном полностью секвенирован. ДНК ВКО реплицируется в цитоплазме инфицированных клеток, а не в ядре, благодаря наличию у вируса генов ДНК-полимеразы, РНК-полимеразы и ферментов, осуществляющих кэпирование, метилирование и полиаденили-рование мРНК. Поэтому, если в геном ВКО встроить чужеродный ген, так чтобы он находился под контролем ВКО-промотора, то он будет экспрессиироваться независимо от регуляторных и ферментных систем хозяина.
ВКО имеет широкий спектр хозяев (позвоночных и беспозвоночных), остается жизнеспособным в течение многих лет после лиофилизации (испарения воды с помощью замораживания) и не обладает онкогенными свойствами, а потому весьма удобен для создания векторных вакцин.
Векторные ВКО-вакцины позволяют провести иммунизацию сразу от нескольких заболеваний. Для этого можно использовать рекомбинантный ВКО, который несет несколько генов, кодирующих разные антигены.
В зависимости от используемого ВКО-промотора чужеродный белок может синтезироваться в ранней или поздней фазе инфекционного цикла, при этом его количество определяется силой промотора. При встраивании в одну ДНК ВКО нескольких чужеродных генов каждый из них помещают под контроль отдельного ВКО-промотора, чтобы предотвратить гомологическую рекомбинацию между различными участками вирусной ДНК, которая может привести к утрате встроенных генов.
Живая рекомбинантная векторная вакцина имеет ряд преимуществ перед неживыми вирусными и субъединичными вакцинами:
1) образование и активность аутентичного антигена практически не отличается от такового при обычной инфекции;
2) вирус может реплицироваться в клетке-хозяине и увеличивать количество антигена, который активирует продукцию антител В-клетками (гуморальный иммунитет) и стимулирует выработку Т-клеток (клеточный иммунитет);
3) встраивание нескольких генов антигенных белков в геном ВКО еще больше уменьшает его вирулентность.
Недостаток живой рекомбинантной вирусной вакцины состоит в том, что при вакцинации лиц со сниженным иммунным статусом (например, больных СПИДом) у них может развиться тяжелая вирусная инфекция. Чтобы решить эту проблему, можно встроить в вирусный вектор ген, кодирующий человеческий интерлейкин-2, который стимулирует Т-клеточный ответ и ограничивает пролиферацию вируса.
Нежелательные побочные эффекты пролиферации ВКО можно предупредить инактивацией вируса после вакцинации. Для этого был создан чувствительный к интерферону вирус (ВКО дикого типа относительно устойчив к его действию), пролиферацию которого можно регулировать в случае возникших при вакцинации осложнений.
Вектор на основе живого аттенуированного полиовируса (его исследования только начинаются) привлекателен тем, что позволяет проводить пероральную вакцинацию. Такие «слизистые» вакцины (вакцины, компоненты которых связываются с рецепторами, расположенными в легких или желудочно-кишечном тракте) пригодны для профилактики самых разных заболеваний: холеры, брюшного тифа, гриппа, пневмонии, мононуклеоза, бешенства, СПИДа, болезни Лайма. Но до любых клинических испытаний любого на первый взгляд безобидного вируса как системы доставки и экспрессии соответствующего гена необходимо убедиться в том, что он действительно безопасен. Например, повсеместно используемый ВКО вызывает у людей осложнения с частотой примерно 3,0-10-6. Поэтому из генома рекомбинантного вируса, который предполагается использовать для вакцинации человека, желательно удалить последовательности, ответственные за вирулентность.
К вакцинам для животных предъявляются менее жесткие требования, поэтому первыми вакцинами, полученными с помощью технологии рекомбинантных ДНК, были вакцины против ящура, бешенства, дизентерии и диареи поросят. Создаются и другие вакцины для животных, а в скором времени появятся и рекомбинантные вакцины, предназначенные для человека.
Еще одним перспективным направлением в создании вакцин нового поколения является использование специально созданных трансгенных растений. Если встроить в геном вирусов этих растений гены, кодирующие синтез имуногенных белков или отдельных антигенных эпитопов различных патогенных микроорганизмов, то растения начнут их экспрессировать. После употребления в пищу таких растений в слизистой желудка и кишечника человека будут вырабатываться соответствующие антитела (так называемые мукозальные антитела). В бананах, например, удалось экспрессировать антиген холерного вибриона, антигены вируса гепатита В, и такие вакцины уже проходят клинические испытания. Антигены декарбоксилазы глутаминовой кислоты экспрессируются в картофеле и оказывают в опытах на животных антидиабетическое действие. Предполагается, что такие “банановые вакцины” в недалеком будущем могут составить серьезную конкуренцию как традиционным, так и генноинженерным вакцинам.
Источник
